王建伟 赵莉 田圃
摘 要 基于“自上而下”的序列分析策略,采用高分辨串联质谱法对德谷胰岛素的氨基酸序列及B链C末端侧链非蛋白修饰序列进行了全面的分析。优化了德谷胰岛素的还原条件及串联质谱的碰撞条件,结果表明,联合使用50 mmol/L三(2-羧乙基)膦及6 mol/L盐酸胍,在45℃下反应40 min即可充分还原德谷胰岛素为两条独立的肽链;还原产物经Accucore C18色谱柱分离,采用静电场轨道阱高分辨串联质谱分析,当高能碰撞诱导裂解能量分别为20(A链)与25(B链)时,可获得最丰富的质谱碎片信息,可满足生物技术药物质量评价中100%的序列覆盖率的基本要求,亦可对问题样品提供更全面的序列解析。此方法未使用传统序列分析中昂贵且费时的测序级蛋白内切酶,降低了引入人为修改的风险,以更准确地获得序列信息,节约了成本,并显著提高了工作效率,为胰岛素类似物的序列分析提供了新的解决方案。
关键词 超高效液相色谱-高分辨串联质谱; 高能碰撞诱导裂解; 德谷胰岛素; “自上而下”序列分析; 序列覆盖率
1 引 言
自从1982年第一个重组生物技术产品即人胰岛素诞生以来,包括治疗性蛋白质在内的生物技术药物(Biotechnology medicine)取得了飞速的发展。 近十年来,生物技术药物在一些疾病治疗方面显示出明显的优势, 出现了一大批明星药物[1,2]。不同于传统的小分子化学药物,生物技术药物一般具有分子量大、结构复杂、稳定性差、批间差异大等特点,因此其质量控制比化学药物更复杂,需要一系列涵盖不同分析领域的分析技术,才能有效地表征其理化属性[3]。《生物技术药物研发与评价技术指导原则》(试行)明确要求,对于蛋白质和多肽类药物,候选药物的氨基酸序列原则上应与参照药相同; 在药学研究与评价时,要求对于氨基酸序列测定的比对试验研究,可与已知的参照药序列直接进行比对。
传统的蛋白质序列分析方法包括N-末端分析法(如二硝基氟苯法、丹磺酰氯法、Edman降解法和氨肽酶法)和C-末端分析法(如肼解法、还原法和羧肽酶法[4])。这些方法操作程序复杂,工作量大。随着质谱技术的飞跃发展,具有高质量精度及宽动态范围等优点的高分辨质谱使得生物技术药物的序列分析更为便捷[5,6]。质谱分析蛋白质序列的原理是基于肽链碰撞碎裂产生规则的碎片(图1),然后根据这些碎片的高分辨质谱信息组合成肽段的氨基酸序列[7]。
利用质谱进行蛋白质的序列分析,通常采用“自下而上”(Bottom-up analysis)的分析方法[8],即首先将完整蛋白经限制性蛋白内切酶酶解成多肽,再利用液相色谱-质谱联用分析,通过软件检索与理论序列的比对,最终鉴定氨基酸序列与预期序列是否一致[9], 这种分析方法应用较为广泛。王绿音等[10]通过液相色谱-质谱联用鉴定经Glu-C酶解产生的肽段,分析得到甘精胰岛素肽图。白海娇等[11]采用Glu-C酶和Lys-C酶过夜反应,特异性水解各种胰岛素,利用液相色谱-质谱联用技术建立含有胰岛素特征性片段的肽图,用于确定各种胰岛素。Srzentic等优化了天冬氨酸蛋白酶Sap9的反应条件,将其用于“自下而上”蛋白质组学中,在酸性条件下Sap9在1 h内可有效裂解IgG,从而降低了将人工修饰引入原始样品的可能性[12,13]。相对于“自下而上”分析,蛋白质不经过酶解直接用质谱仪分析的方法即“自上而下”分析(Top-down analysis),大大降低了检测成本与样品处理时间,也避免了由酶解引入的人为修改,所得的结果更简洁,因而易于分析。然而,未经酶解的完整肽链长度远大于酶解后的肽段长度,其质谱信号弱,导致采用“自上而下”分析法得到的肽段覆盖率相对有限,对质谱分析提出了更高的技术要求,包括质谱碎裂条件和质量分析器的分辨率等,同时也对庞大的质谱数据分析提出了挑战[14]。Levy等[15]采用最先进的Fusion系列靜电场轨道阱高分辨质谱仪,联合多种质谱碎裂方式和多级串联质谱分析粒细胞刺激因子, 获得了89%的蛋白序列覆盖率。Fornelli等[16]通过多种离子活化技术实现了对利妥昔单克隆抗体的“自上而下”质谱序列分析,序列覆盖率大于90%。
糖尿病是威胁人类健康的主要疾病之一,重组人胰岛素和胰岛素类似物是治疗糖尿病的首选药物。目前有6种胰岛素类似物应用于糖尿病临床治疗。相较于重组人胰岛素,长效胰岛素类似物吸收和扩散缓慢稳定,药效平稳、无明显峰效应,且作用时间长,能模拟正常人生理性基础胰岛素分泌[17]。德谷胰岛素[18]是最新开发出的胰岛素类似物,是目前临床上作用时间最长的胰岛素类似物。德谷胰岛素属于化学修饰的重组人胰岛素,是在人胰岛素分子的基础上,将B链第30位的苏氨酸去掉,在B链第29位赖氨酸侧链的ε氨基上,通过一个L-γ-谷氨酸连接子,共价偶联了一个16碳的脂肪二酸(图2)。
德谷胰岛素同重组人胰岛素和其它胰岛素类似物一样均为双链结构,需要对两条肽链分别进行序列分析,本研究采用“自上而下”的分析策略,将德谷胰岛素还原后,不经酶解即采用超高液相色谱-静电场轨道阱高分辨串联质谱(UPLC-LTQ Orbitrap MS)进行分析,优化了德谷胰岛素还原成两条单链的反应条件,以及串联质谱的碰撞条件,实现了德谷胰岛素的序列表征,包括德谷胰岛素A链和B链蛋白序列分析、B链C末端侧链非蛋白修饰序列分析。本研究为德谷胰岛素等胰岛素类似物生产的质量控制和药品质量监管提供了新方法。
2 实验部分
2.1 仪器与试剂
Acquity UPLC超高效液相色谱系统(美国Waters公司); Orbitrap Velos Pro静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司); MS3涡旋振荡器(德国IKA公司); DHG-9145A电热恒温鼓风干燥箱(上海一恒科学仪器有限公司)。
德谷胰岛素注射液(3 mL, 300单位, 丹麦诺和诺德制药有限公司); 三(2-羧乙基)膦(TCEP)、甲酸、盐酸胍(美国Sigma-Aldrich公司); 乙腈(色谱级,美国Thermo Fisher Scientific公司); NH4HCO3、HCl(分析纯,北京化工厂)。
2.2 实验方法
2.2.1 德谷胰岛素二硫键的还原 德谷胰岛素注射液用10 mmol/L HCl溶液稀释成1 mg/mL,取100 μL至离心管内,加入终浓度分别为6 mol/L的盐酸胍和50 mmol/L的TCEP, 45℃孵育40 min,使德谷胰岛素的二硫键还原打开,两条肽链分离。还原产物用UPLC-LTQ Orbitrap MS分析,进样量为2 μL。
2.2.2 仪器分析条件 液相色谱条件: Accucore C18色谱柱(100 mm × 2.1 mm,2.6 μm,美国Thermo Fisher Scientific公司); 柱温45℃; 流动相A为含0.1%甲酸的乙腈溶液,流动相B为0.1%甲酸。线性梯度洗脱: 0~3 min,3% A; 3~17 min,3%~60% A; 17~18 min,60%~95% A; 18~22 min,95% A; 22~22.1 min,95%~3% A; 22.1~25 min,3% A。流速: 0.3 mL/min。
质谱条件: 加热电喷雾离子源(HESI); 正离子检测模式; 喷雾电压3.0 kV; 离子传输管温度320℃; 辅助气温度300℃; 鞘气: 35 arb; 辅助气: 10 arb; S-Lens RF值: 50.0%; 扫描模式: 数据依赖型扫描模式(Full MS/dd-MS2); 扫描范围: m/z 150~2000; 一级质谱分辨率为60000 FWHM(m/z 400),二级质谱分辨率为15000 FWHM(m/z 400); 二级质谱碎裂模式: 碰撞诱导解离(Collision-induced dissociation,CID)、高能碰撞诱导裂解(Higher energy collision induced dissociation, HCD); 碰撞能量(Normalized collision energy, NCE)优化范围: 10~45。
2.2.3 数据分析条件 数据采集软件: Thermo Xcalibur 2.2,数据处理软件: BioPharma Finder 3.2,分子量计算软件: ChemBioDraw 14.0,计算所有的a、b、c、x、y和z型碎片离子分子量,按照5 ppm的误差匹配质谱信号。
3 结果与讨论
3.1 德谷胰岛素还原条件的优化
蛋白质中存在二硫键时,会影响其二级质谱中肽链的碎裂[19],无法获得序列分析所需的丰富的碎片离子,因此,在质谱检测前需将二硫键还原打开。常用的二硫键还原试剂包括二硫苏糖醇(DTT)和三(2-羧乙基)膦(TCEP),其中,DTT是一种高效的链间二硫键还原剂,而TCEP与蛋白变性剂结合可同时还原链间和链内二硫键[20]。在还原反应过程中,
如发生过度还原(如高温或者长时间反应),则会产生干扰物质[21,22],因此,选择合适的反应温度与时间是保证序列分析准确性的前提。在德谷胰岛素的结构中,除了存在两条链间的二硫键,A链中还存在链内二硫键,因此,本研究采用TCEP与蛋白变性剂盐酸胍结合的方法进一步优化了TCEP的还原温度和还原时间。
德谷胰岛素有3个二硫键,理论上,其还原反应会产生8个还原产物。图3为德谷胰岛素的还原产物经UPLC-LTQ Orbitrap MS分析的色谱图,具体色谱峰归属见表1。峰1为存在链内二硫键的A链,峰2为还原后的A链,峰4、5、6为A链和B链间存在两条二硫键的还原产物,峰7为还原后的B鏈,峰8、9为A链和B链间存在一条二硫键的还原产物。其中,B链(峰7)第29位赖氨酸上修饰了16碳二酸谷氨酰脂肪链,其极性明显小于A链(峰2),因此,在C18色谱柱中B链液相色谱保留时间远大于A链。TCEP能稳定还原德谷胰岛素的链间和链内二硫键,如图4所示,50 mmol/L TCEP联合6 mol/L盐酸胍在45℃反应,德谷胰岛素的含量快速下降,还原后的A链和B链含量迅速升高,在40 min内即可充分还原德谷胰岛素成两条肽链。
3.2 质谱碎裂条件的优化
德谷胰岛素经TCEP还原后,不经酶解即注入UPLC-LTQ Orbitrap MS进行“自上而下”序列分析。为了获得更多的德谷胰岛素碎片离子,比较了两种常用的串联质谱碎裂方式: CID和HCD。CID是生物质谱中肽段序列分析常用的碎裂模式,肽段活化碰撞后主要产生b、y型碎片离子,进而解析序列。CID主要在肽链的主链发生碎裂,且在离子阱中有“1/3效应”,不能检测到小于母离子质荷比28%的碎片离子。 HCD是一种高效的肽链碎裂模式,在轨道阱质谱仪中广泛应用。HCD比CID更容易发生二次碎裂,有可能产生更多的碎片离子,从而能对肽链的侧链修饰进行分析。此外,HCD利用轨道阱检测离子,克服了离子阱中CID的“1/3效应”,扫描范围更广,可检测到低质荷比区域的离子[23]。文献[23,24]比较了CID和HCD在N-糖肽中肽段序列和侧链糖链结构分析中的差异,表明HCD能获得更全面的糖肽序列信息。
3.2.1 德谷胰岛素A链的序列分析 德谷胰岛素A链由21个氨基酸组成,含有20个酰胺键,其一级质谱主要出现双电荷峰和三电荷峰。分别考察了CID和HCD模式下, NCE对德谷胰岛素A链碎裂程度的影响(图5)。在CID模式下,A链的b离子和y离子碎片都很丰富,检测到的酰胺键断裂数随着NCE增加而增大,
图5 在 CID (A)和 HCD (B)模式下,NCE 对德谷胰岛素A链双电荷或三电荷峰碎裂的影响
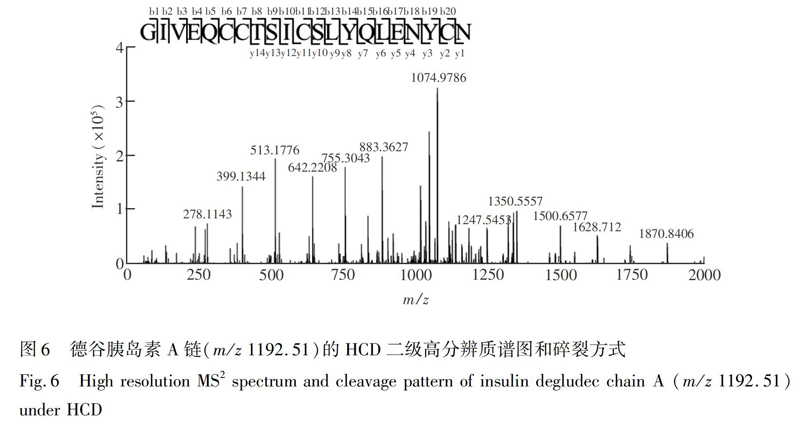
Fig.5 Effect of normalized collision energy (NCE) on fragmentation efficiency curves of doubly or triply protonated insulin degludec chain A under collision-induced dissociation (CID) (A) or higher energy collision induced dissociation HCD (B) over the NCE range of 10-45最高達到18个。 在HCD模式下,A链的碎片离子更丰富。由图5B可见,当NCE>25时,由于高能碰撞造成的二次碎裂使得碎片难于被匹配,而在NCE=20时,HCD模式能检测到双电荷峰(m/z 1192.51)所产生的全部20个酰胺键的断裂,序列覆盖率达到100%(图6)。具体HCD裂解片段的质谱峰归属见电子版文后支持信息表S1。
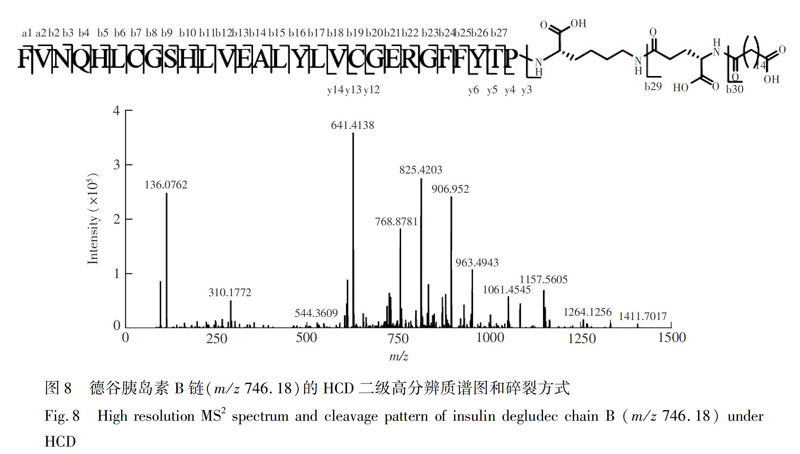
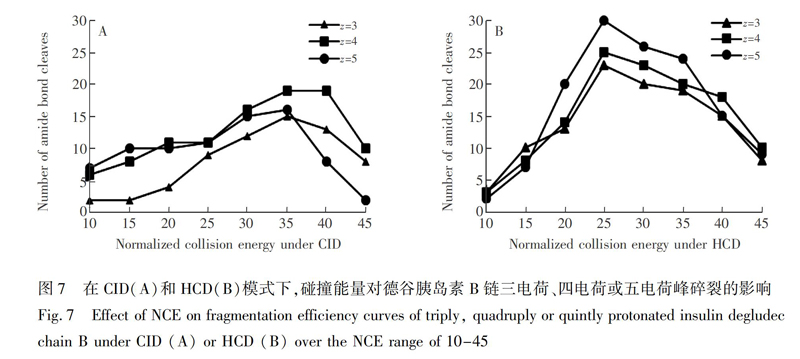
3.2.2 德谷胰岛素B链的序列分析 德谷胰岛素B链是由29个氨基酸组成的肽链,以及类似N-糖肽键修饰的C末端第29位赖氨酸侧链ε氨基上的非蛋白序列组成,共含有30个酰胺键,其一级质谱主要出现了三电荷、四电荷和五电荷的谱峰。在CID和HCD模式下,德谷胰岛素B链呈现出与A链类似的碎裂程度(图7)。在CID模式下,检测到的酰胺键断裂数最高达到19个,且只能在主链发生碎裂。在HCD模式下,碎片离子更丰富,不仅能检测到主链的酰胺键断裂,还能检测到C末端侧链氨基上非蛋白序列修饰的酰胺键断裂。在NCE=25时,能检测到五电荷峰(m/z 746.18)所产生的全部30个酰胺键断裂,序列覆盖率达到100% (图8)。因此,在德谷胰岛素B链的序列分析中,HCD比CID碎裂模式更具优势。具体HCD裂解片段的质谱峰归属见电子版文后支持信息表S2。
4 结 论
采用“自上而下”高分辨质谱法对德谷胰岛素进行了完整的序列分析,序列覆盖率达到100%。本研究未使用传统序列分析中的昂贵且费时的测序级蛋白内切酶,改用TCEP联合盐酸胍还原德谷胰岛素双链,结合HCD质谱碎裂方式得到丰富的b、y型等碎片离子,用于其蛋白主链及侧链非蛋白修饰部分的序列解析。本方法准确、便捷,为德谷胰岛素等胰岛素类似物的质控提供了新思路,并可用于其它胰岛素类似物的序列分析。
References
1 Tibaldi J M. Am. J. Med., 2014, 127(10): S25-S38
2 Háda V, Bagdi A, Bihari Z, Timári S B, Fizil A, Szántay C. J. Pharmaceut. Biomed. Anal., 2018,? 161: 214-238
3 QI Lian-Quan, BAI Yu, LUO Jian-Hui, Acta Pharmaceutica Sinica, 2019,? 54(11): 2113-2117
齐连权, 白 玉, 罗建辉. 药学学报, 2019,? 54(11): 2113-2117
4 WANG Jing-Yan, ZHU Sheng-Geng, XU Chang-Fa. Biochemistry. Beijing: Higher Education Press, 2002:? 169
王镜岩, 朱圣庚, 徐长法.? 生物化学(第三版上册).? 北京: 高等教育出版社, 2002:? 169
5 Rogers R S, Nightlinger N S, Livingston B, Campbell P, Bailey R, Balland A. mAbs, 2015,? 7(5): 881-890
6 LIN Lin, LUO Shu-Sheng, WANG Ling-Yu, YANG Jie, SHEN Hai-Nan, TIAN Rui-Jun. Chinese J. Anal. Chem., 2015,? 43(10): 56-66
林 琳, 罗树生, 王灵珏, 杨 杰, 沈海南, 田瑞军.? 分析化学,? 2015,? 43(10): 56-66
7 Papayannopoulos I A. Mass Spectrom. Rev., 1995,? 14: 49-73
8 Giorgetti J, Beck A, Leize-Wagner E, Franois Y N. J. Pharmaceut Biomed. Anal., 2020,? 182:113107
9 Farrell A, Carillo S, Scheffler K, Cook K, Bones J. Anal. Methods, 2018,? 10(25): 3100-3109
10 WANG Lü-Yin, YANG Hui-Min, LI Jing, ZHANG Hui, LI Yi, ZHANG Wei, LIANG Cheng-Gang. Letters in Biotechnology, 2018,? 29(05):87-96
王绿音, 杨慧敏, 李 晶, 张 慧, 李 懿, 张 伟, 梁成罡.? 生物技术通讯,? 2018,? 29(05):87-96
11 BAI Hai-Jiao, HAN Xiao-Jie, FU Sheng-Qing, SHAO Jian-Qiang. China Patent, 201910663742.5, 2019
白海娇, 韩晓捷, 伏圣青, 邵建强.? 中国专利,? 201910663742.5, 2019
12 Srzentic K, Fornelli L, Laskay U A, Monod M, Beck A, Ayoub D, Tsybin Y O. Anal. Chem., 2014,? 86(19): 9945-9953
13 LaskayA, Srzentic' K, Monod M, Tsybin Y O. J. Proteomics, 2014,? 110: 20-31
14 Schaffer L V,Millikin R J, Miller R M, Anderson L C, Fellers R T, Ge Y, Kelleher N L, LeDuc R D, Liu X, Payne S H, Sun L, Thomas P M, Tucholski T, Wang Z, Wu S, Wu Z, Yu D, Shortreed M R, Smith L M. Proteomics, 2019,? 19(10): 1800361
15 Levy M J, Gucinski A C, Boyne M T. Anal. Chem., 2015,? 87(14): 6995-6999
16 Fornelli L, Srzentic' K, Huguet R, Mullen C, Sharma S, Zabrouskov V, Fellers R T, Durbin K R, Compton P D, Kelleher N L. Anal. Chem., 2018,? 90(14): 8421-8429
17 YIN Hua-Jing, YU Shan-Shan, YIN Mao-Shan, WANG Yin, WU Shuang, LI Zheng, HU Xiao-Min. Chinese Journal of New Drugs, 2018,? 27(21):118-123
尹華静, 余珊珊, 尹茂山, 王 寅, 吴 爽, 李 峥, 胡晓敏.? 中国新药杂志,? 2018,? 27(21): 118-123
18 Jonassen I, Havelund S, Hoeg-Jensen T, Steensgaard D B, Wahlund P, Ribel U. Pharm. Res., 2012,? 29: 2104-2114
19 Rush M J, Riley N M, Westphall M S, Coon J J. Anal. Chem., 2018,? 90(15): 8946-8953
20 Bobaly B, DAtri V, Goyon A, Colas O, Beck A, Fekete S, Guillarme D. J. Chromatogr. B, 2017,? 1060: 325-335
21 Formolo T, Ly M, Levy M, Kilpatrick L, Lute S, Phinney K, Schiel J. Determination of the NISTmAb Primary Structure. In: Schiel J E, Davis D L, Borisov O V, Editors. State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 2. Biopharmaceutical Characterization: the NISTmAb Case Study. American Chemical Society, 2015: 1-62
22 Zhang B, Jeong J, Burgess B, Jazayri M, Tang Y, Zhang Y T. J. Chromatogr. B, 2016,? 1032: 172-181
23 JIANG Jing, YING Wan-Tao, QIAN Xiao-Hong. Chinese J. Anal. Chem., 2014,? 42(2): 159-165
江 静, 应万涛, 钱小红. 分析化学,? 2014,? 42(2): 159-165
24 ZENG Wen-Feng, ZHANG Yang, LIU Ming-Qi, WU Jian-Qiang, ZHANG Xiao-Jin, YANG Hao, LIU Chao, CHI Hao, ZHANG Kun, SUN Rui-Xiang, YANG Peng-Yuan, HE Si-Min. Progress in Biochemistry and Biophysics, 2016,? 43(6): 550-562
曾文锋, 张 扬, 刘铭琪, 吴建强, 张晓今, 杨 皓, 刘 超, 迟 浩, 张 昆, 孙瑞祥, 杨芃原, 贺思敏.? 生物化学与生物物理进展,? 2016,? 43(6): 550-562
Sequence Analysis of Insulin Degludec by Top-Down
High Resolution Tandem Mass Spectrometry
WANG Jian-Wei1,2, ZHAO Li1, TIAN Pu*1
1(School of Life Sciences, Jilin University, Changchun 130012, China)
2(National Analytical Research Center of Electrochemistry and Spectroscopy, Changchun Institute of Applied Chemistry,
Chinese Academy of Sciences, Changchun 130022, China)
Abstract The "top-down" high-resolution tandem mass spectrometry method was used for the first time to comprehensively analyze the amino acid sequence of insulin degludec and the non-protein modification sequence of C-terminal side chain of B-chain. The reduction conditions of insulin degludec and the collision conditions of tandem mass spectrometry were optimized. The results indicated that insulin degludec could be fully reduced to two independent peptide chains when tris(2-carboxyethyl) phosphine (50 mmol/L) and guanidine hydrochloride (6 mol/L) were used in combination and reacted for 40 min at 45℃. The reduction products were separated by Accucore C18 column and analyzed by orbitrap high resolution tandem mass spectrometry. When the higher energy collision induced dissociation was 20 for Chain A and 25 for Chain B, the most abundant fragment information could be obtained, which not only met the basic requirements of 100% peptide coverage in biotechnology drug evaluation, but also provided more comprehensive sequence analysis for the problem samples. This method eliminated the costly enzymatic hydrolysis step in the traditional sequence analysis, limited the risk of introducing artifactual modification to obtain better sequence information, thus saved the cost and significantly improved work efficiency, and provided a new solution for sequence analysis of insulin analogs such as insulin degludec.
Keywords Ultra performance liquid chromatography-high resolution tandem mass spectrometry; Higher energy collision induced dissociation; Insulin degludec; Top-down analysis; Sequence coverage
(Received 17 March 2020; accepted 17 April 2020)
2020-03-17收稿; 2020-04-17接受
* E-mail: tianpu@jlu.edu.cn
- 采用蜜罐技术的工业控制网络入侵检测算法研究
- 突发公共事件视域下高校网络信息安全管理研究
- 费雪耶兹算法结合混沌理论的图像加密方案
- 基于NSGA-Ⅱ算法的孤岛微电网优化调度
- 空间飞行器中可见光通信系统布局及性能分析
- 基于LM算法的机械臂轨迹规划研究
- 数字孪生驱动的造船精细化工时管理模式及应用研究
- 基于AGA-BP的发酵过程智能补料控制策略
- 改进EEMD算法在缸盖振动信号降噪中的应用研究
- 基于自动生成技术的三维动画型微课场景设计
- 大型民机系统纵向Nz控制律设计
- 基于CCD的回波信号图预处理软件设计与实现
- 基于微信小程序的云班课管理系统设计
- 基于FreeRTOS的实验设备柜控制器研究与设计
- 基于红帽Linux的银行排队叫号系统
- 基于STM32F103的J1939多包传输底层软件设计
- 基于区块链的高校联盟学分管理系统研究
- 可回收外周血管支架设计与生物力学研究
- 分布式主题舆情采集与分析系统设计
- 基于微信小程序的教学评价平台设计与实现
- 针对步行平衡稳定性的外骨骼欠驱动髋关节设计
- 测距系统中运用误差系数减小测距误差的方法
- 基于UKF算法的电池荷电状态SOC估算研究
- 基于XGBoost与协方差特征的频谱感知算法
- 面向农户贷款信用风险评估的Relief-GEP模型
- preprovided
- preprovides
- preproviding
- preproving
- preprovision
- preprovisions
- preprovocation
- preprovocations
- preprovoke
- preprovoked
- preprovokes
- preprovoking
- preprudent
- preprudently
- preps'
- preps
- prep school
- prep-schools
- prep schools
- prepsychedelic
- prepsychological
- prepsychologies
- prepsychology
- prepunish
- prepunished
- 治学范围广,但不精深
- 治学要弄清源流
- 治学,研究学业
- 治安
- 治安强化运动
- 治安管理
- 治安警察
- 治官
- 治定
- 治宜
- 治实
- 治室
- 治害
- 治家
- 治家严,家乃和;居乡恕,乡乃睦
- 治家的礼法
- 治家者先修己,修己者先正心
- 治家过日子很勤谨
- 治山容易治人难
- 治差
- 治巴
- 治席
- 治席容易请客难
- 治席容易,请客难
- 治干