崔筱 张玉亭 刘芹 孔维威 康源春 胡素娟 袁瑞奇 宋志波 孔维丽
摘? ? 要: 為了筛选促进菌丝体及子实体生长的IAA浓度,以平菇菌株P99为对象,研究了不同外源IAA浓度(0、10-3、10-5、10-8、10-10、10-12 mol·L-1)对平菇菌丝菌落直径、菌丝干质量、平菇原基形成时间、菇蕾数量、平菇产量、内源IAA含量、IAA氧化酶活性变化的影响。结果表明,菌丝体发育阶段,随着外源IAA浓度的降低,菌丝生长速度增快,但当IAA浓度达到10-10 mol·L-1时,菌丝生长速度变慢;随着菌丝生长,内源生长素含量随着生长素氧化酶活性的逐渐降低而逐渐升高,第7天达到峰值;当添加高浓度外源IAA时,菌丝内源生长素含量急剧增长,生长素氧化酶活性急剧下降,在第7天达到峰值。子实体发育阶段,添加10-8 mol·L-1的外源生长素可使原基提前3天形成,菇蕾数量较对照组多24.23%,子实体产量及生物学效率较对照组提高了12.12%;随着子实体的发育,在原基期,IAA含量最低,IAA氧化酶活性达到最高值,随着外源IAA浓度降低到10-8 mol·L-1时,内源IAA含量降至最低,生长素氧化酶活性升至最高。因此,外源IAA通过影响平菇内源IAA分泌及生长素氧化酶活性,影响平菇生长发育过程,这些结果可为平菇生长发育期添加外源IAA提供理论依据。
关键词:平菇;IAA;菌丝生长;子实体发育
中图分类号:S646.14? ? ? ? ? 文献标识码:A? ? ? ? ? ?DOI 编码:10.3969/j.issn.1006-6500.2020.10.007
Changes of IAA Content and IAA Oxidase Activity in Pleurotus Ostreatus During Growth and Development
CUI Xiao, ZHANG Yuting, LIU Qin, KONG Weiwei, KANG Yuanchun, HU Sujuan, YUAN Ruiqi, SONG Zhibo, KONG Weili
(Agricultural Resources and Environmental Science, Henan Academy of Agricultural Sciences, Zhengzhou,Henan 450002, China)
Abstract:In order to explore the influence of exogenous IAA on the mycelium growth stage of Pleurotus ostreatus and endogenous IAA, the effects of different exogenous IAA concentrations (0、10-3、 10-5、 10-8、10-10、 10-12 mol·L-1) on mycelium colony diameter,mycelium dry mass,primordium formation time,mushroom bud number,yield,the content of endogenous IAA and? changes of IAA oxidase activity of Pleurotus ostreatus were studied. The results showed that during the stage of mycelium development, with the decrease of exogenous IAA concentration, the mycelium grew faster, however, when the concentrationwas 10-10 mol·L-1, the growth rate of mycelia slowed down; with the growth of mycelia, the content of auxin increased with the decrease of auxin oxidase activity and reaching the peak on the 7th day. When high concentration of exogenous IAA was added, the content of endogenous auxin in mycelia increased sharply whereas auxin oxidase activity decreased sharply and also reaching the peak on the 7th day. During the developmental stage of the fruiting body, the addition of 10-8 mol·L-1 exogenous auxin could advance the formation of primordia by 3 days and the number of mushroom buds was 24.23% more than that of the control group, and the yield and biological efficiency of fruiting bodies were 12.12% higher than that of the control group; With the development of fruiting bodies, IAA content was the lowest and IAA oxidase activity reached the highest in the primary stage, When the concentration of exogenous IAA decreased to 10-8 mol·L-1, the content of endogenous IAA decreased to the minimum but auxin oxidase activity rose to the highest level. Above all, exogenous IAA affects the growth and development of Pleurotus ostreatus by affecting the secretion of endogenous IAA and activity of auxin oxidase, all of these results can provide theoretical basis for adding exogenous IAA to Pleurotus ostreatus during growth and development.
Key words: Pleurotus ostreatus; IAA; mycelial growth; fruiting body development
生长素(IAA)是调控植物生长发育最重要的植物激素之一,在植物体内参加了细胞伸长生长、形成层细胞分裂、维管组织分化、叶片和花的脱落等许多生理生化过程的调节与控制,也影响营养器官和生殖器官的生长、成熟和衰老[1-2]。传统观点认为,生长素生物合成主要在幼嫩的叶组织和茎尖顶端分生组织[3]。近几年研究发现,在特定发育信号或环境信号诱导下,植物体的所有组织或器官均能快速有效地合成生长素,以满足特定组织(器官)生长和环境响应的需要[4-7],许多园艺作物,例如番茄、草莓、木瓜、葡萄等,生长素的含量随着果实成熟而下降[8-10],植物体内快速分裂和生长的部位,如茎叶分生组织、幼嫩的叶片等组织中合成生长素较多,幼嫩的果实和种子中生长素的含量也很高[8]。另有研究表明,生长素具有两重性,在一定范围内,随着生长素浓度的增加,促进作用逐渐增强,当生长素浓度大于一定值时,植物的生长受到抑制[11]。关于生长素的研究,大多在植物中进行,在食用菌领域,对其研究较少,尤其在平菇研究方面。
平菇(Pleurotus ostreatus)学名侧耳,又名北风菌、冻菌、蚝菌、鲍鱼菇等,是四极性异宗结合的食用菌。在分类学上属真菌门,担子菌亚门(Basidiomycotina),伞菌目(Agaricales),侧耳科(Pleurotaceae),侧耳属(Pleurotus)[12]。平菇整个发育过程中包括两个阶段,菌丝生长阶段和子实体阶段,菌丝生长阶段是由孢子萌发发育成单核菌丝,单核菌丝质配形成双核菌丝的菌丝体。菌丝体发育到一定程度,在适宜培养条件下形成其繁殖器官——子实体。平菇子实体从小到大依次有瘤状突起、桑葚状原基、珊瑚状菇蕾、扇贝状平菇、成熟平菇等4~5种形态,原基的发生标志平菇的生活史由菌丝体生长转入子实体发育阶段[13],当条件适宜时,从瘤状突起长成可以采食的成熟平菇,需10天左右。发育周期的长短是影响平菇栽培成本高低的重要因素,缩短平菇生长发育期有两种方法,一种是缩短菌丝生长期,一种是缩短子实体形成期。目前,平菇生长发育相关的研究主要集中在外界环境因子(如光照、温度和氧气等)方面,生长素对平菇生长发育影响的报道较少,本研究拟通过研究生长素(IAA)对平菇P99菌丝体期及子实体期的生理影响,为进一步研究与生长素合成相关的基因调控平菇P99生长发育机理和平菇生产实践提供数据支撑。
1 材料和方法
1.1 试验材料
平菇菌株为“P99”,由河南省农业科学院植物营养与资源环境研究所食用菌研究開发中心菌种库保存。
IAA购自Solarbio公司。
PDA、PDB培养基均购自北京奥博星生物技术有限责任公司,按照产品说明配制完成后,115 ℃高压蒸汽灭菌30 min备用。
培养料配方:棉籽壳93%,麸皮5%,石灰2%。
1.2 试验方法
1.2.1 不同浓度IAA配制 利用无水乙醇作为溶剂,把吲哚-3-乙酸配置成10-5 mol·L-1、10-8 mol·L-1、10-10 mol·L-1、10-12 mol·L-1浓度的生长素溶液。
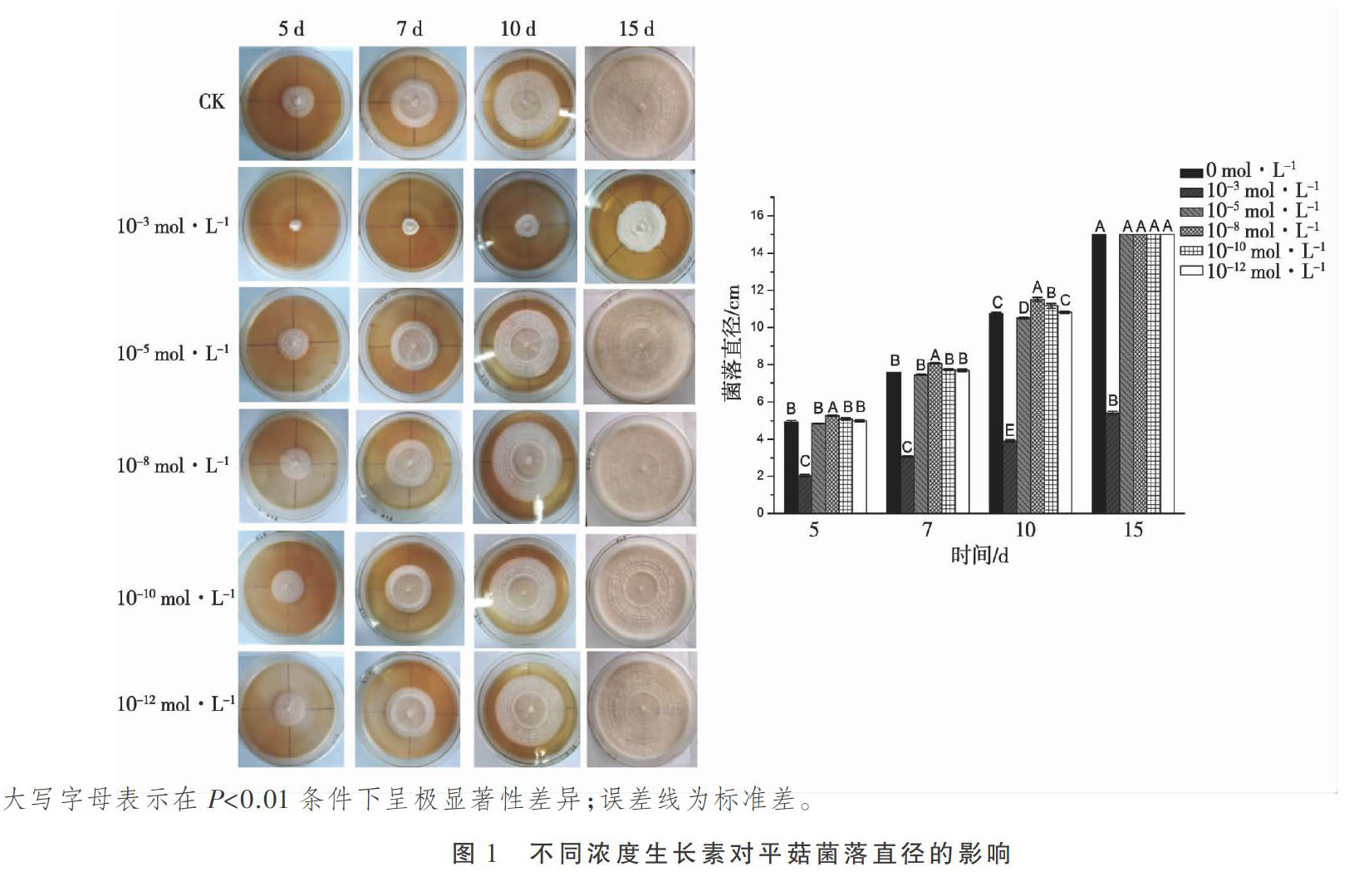
1.2.2 添加不同浓度IAA对平菇菌落直径的影响? 用直径5 mm的打孔器将活化后的P99菌株接种到直径为15 mm、含有经过滤除菌的不同浓度(10-3、10-5、10-8、10-10、10-12 mol·L-1)生长素溶液的PDA平板上,置于25 ℃恒温培养箱中黑暗培养,并测量第5 d、7 d、10 d、15 d P99菌株的菌落直径,以不添加生长素的平板作为对照,每一处理3个重复。
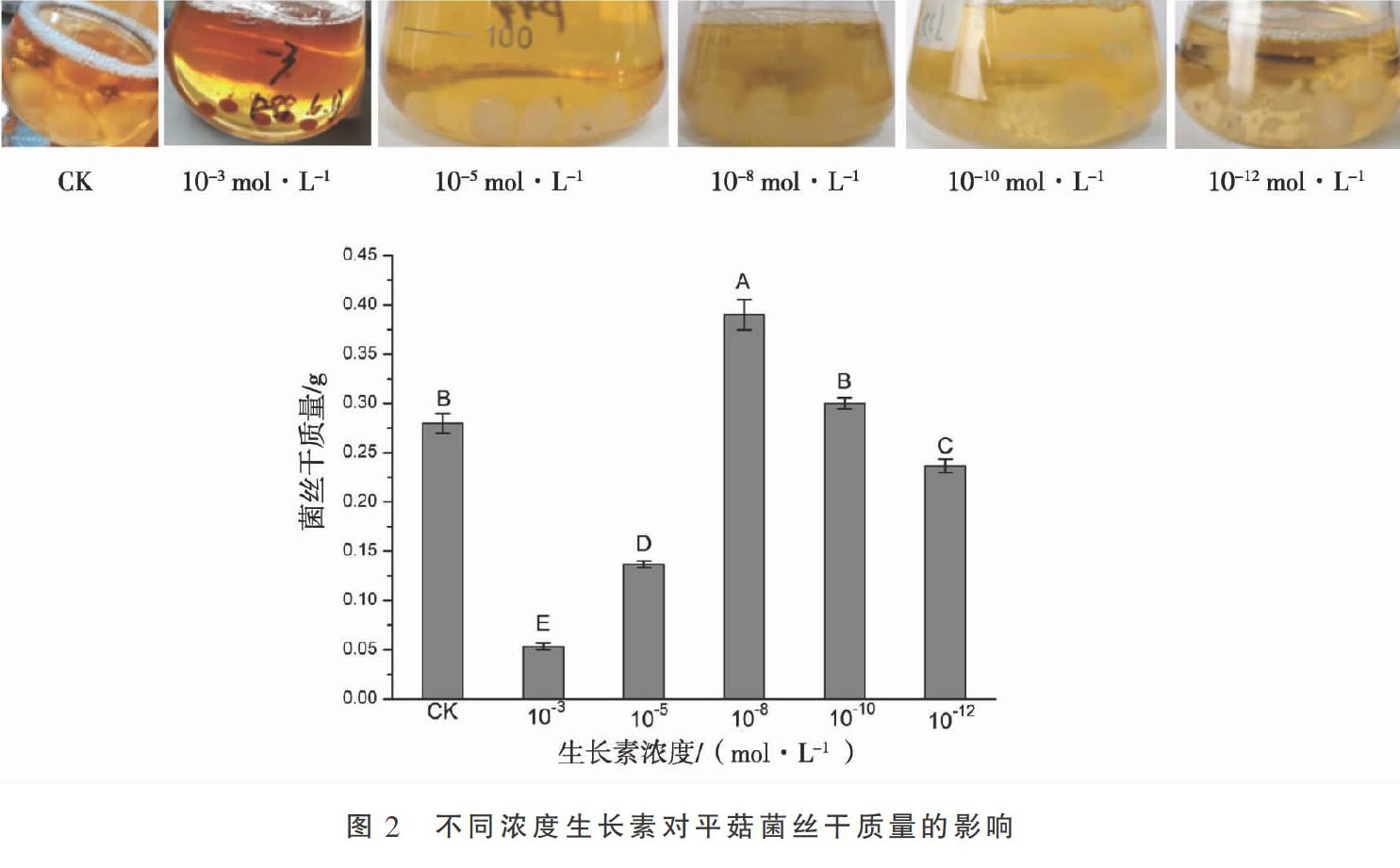
1.2.3 添加不同浓度IAA对平菇菌丝干质量的影响 用直径5 mm的打孔器将活化后的P99菌株接种到100 mL加有经过滤除菌的不同浓度(10-3、10-5、10-8、10-10、10-12 mol·L-1)生长素溶液的PDB液体培养基中,于150 rpm、25 ℃恒温摇床中黑暗培养7 d,7 d后收集菌丝,置于60 ℃烘箱中烘干至恒定质量,称取每一处理的菌丝重量。以不添加生长素的培养基作为对照,每一处理3个重复。
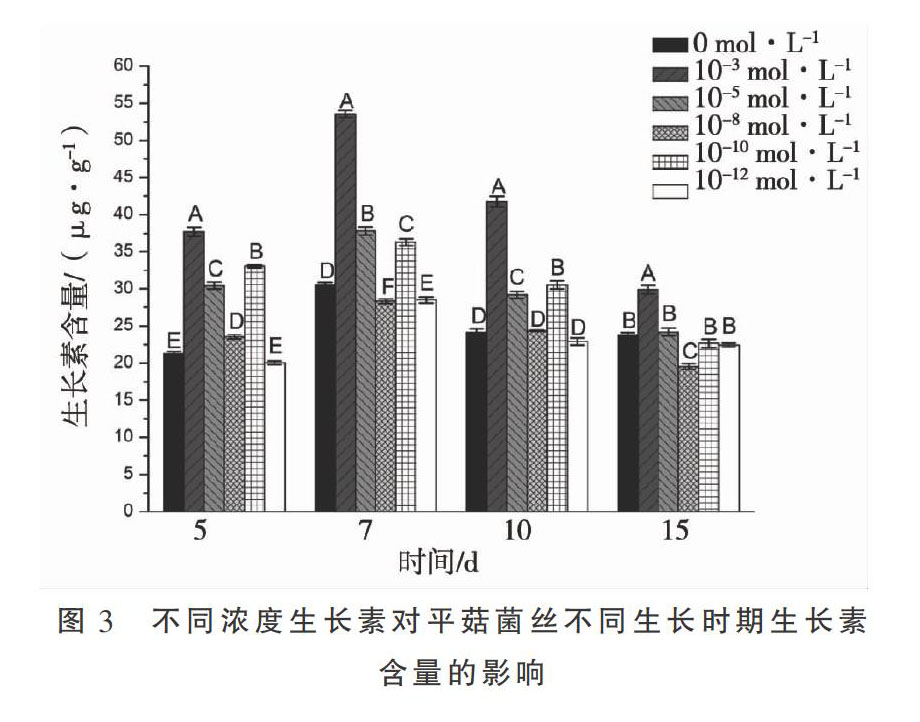
1.2.4 添加不同浓度IAA对平菇菌丝内源IAA的影响 取不同浓度处理后的平菇菌丝,测定内源IAA的含量。参照植物中生长素含量的测定方法[14],略有改动。称取1 g新鲜平菇的菌丝体于无菌研钵中,迅速加入4 mL 80%冰甲醇研磨,吸取研磨的匀浆液于50 mL无菌离心管中加入80%冰甲醇使终体积为10 mL,于4℃,5 000 rpm·min-1离心10 min,离心2次,弃沉淀,留上清液,所得上清即为IAA提取液。按照植物中生长素含量测定方法测定,每一样品做三次重复。生长素含量计算公式如下:
样品吲哚乙酸含量(μg·g-1)=(A×V1)/(W×V2) (1)
式中,A为标准曲线上查得的IAA量(μg),V1为样品提取液体积(mL),W为样品重量(g),V2为样品反应液体积(mL)。
1.2.5 添加不同浓度IAA对平菇菌丝IAA氧化酶活性的影响 取不同浓度处理后的平菇菌丝,测定菌丝体IAA氧化酶活性。参照植物中吲哚乙酸氧化酶活性的测定方法[15],略有改动。称取0.5 g新鲜平菇的菌丝体于无菌研钵中,迅速加入预冷的磷酸缓冲液(pH=6.1)5 mL,冰浴研磨,于4 ℃,4 000 rpm离心20 min,弃沉淀,留上清液,再将上清液于4 ℃,4 000 rpm离心20 min,所得上清液,即为粗酶液。按照植物中吲哚乙酸氧化酶活性测定方法测定,每一样品做3次重复。吲哚乙酸氧化酶活性计算公式如下:
IAA氧化酶活性(μ mol·g-1·h-1)=(C对照-C实验)×? ? ? ? ? ?VT×V/(W×t×V1) (2)
式中,C对照为对照组530 nm处IAA浓度,C实验为实验组530 nm处IAA浓度,VT为酶液总体积,V为IAA氧化酶与IAA的反应液体积,V1为反应所用酶液体积,W为样品重量,T为酶促时间。
1.2.6 喷施不同浓度IAA对平菇子实体发育的影响 栽培袋选用14 cm×28 cm×0.005 cm聚丙烯袋,每袋重250 kg,干料质量150 kg,菌丝满袋后,开口出菇,每袋喷施10 mL不同浓度(10-3、10-5、10-8、10-10、10-12 mol·L-1)的IAA溶液,以不喷施生长素的菌袋作为对照(CK),设置3个重复。喷施IAA后,保持菇房内温度15~20 °C,湿度80%~90%,二氧化碳浓度600 ppm,光照强度150 Lux,每隔6~8 h观察平菇栽培袋原基形成情况,并记录原基形成的时间;原基形成后,继续观察并统计每袋栽培袋中的菇蕾数量;平菇子实体长至六成熟后,采摘并称重,计算总产量、生物学效率,并记录好时间。生物学计算公式如下:
生物学效率(%)=平菇产量/干料质量×100? ? ? (3)
1.2.7 喷施不同浓度IAA对平菇子实体内IAA含量的影响 收集各处理条件下子实体不同发育阶段(原基期、珊瑚期即原基形成后1 d、幼菇期即原基形成后2 d、成熟期即原基形成后3 d、衰萎期即原基形成后5 d)的子实体,测定不同处理下平菇子实体内IAA含量的变化,方法参照1.2.4。
1.2.8 喷施不同浓度IAA对子实体IAA氧化酶活性的影响 收集各处理条件下子实体不同发育阶段(原基期、珊瑚期即原基形成后1 d、幼菇期即原基形成后2 d、成熟期即原基形成后3 d、衰萎期即原基形成后5 d)的子实体,测定不同处理平菇子实体内IAA氧化酶活性的变化,方法参照1.2.5。
1.3 数据处理
数据处理采用SPSS19.0软件进行单因素方差分析LSD法。
2 结果与分析
2.1 不同浓度IAA对平菇菌丝生长速度的影响
结果表明,添加不同浓度外源IAA对菌丝生长速度影响差异显著,添加10-3 mol·L-1的IAA时,P99菌丝生长速度极显著性变慢(P<0.01);当添加10-8 mol·L-1、10-10 mol·L-1生长素溶液时,P99菌丝生长速度极显著性增快(P<0.01),但与添加10-8 mol·L-1IAA溶液的菌株生长速度相比,添加10-10 mol·L-1IAA溶液的菌株生长速度极显著性慢于添加10-8 mol·L-1生长素溶液的菌株生长速度(P<0.01);当添加的生长素溶液浓度为10-12 mol·L-1时,P99菌丝生长速度无显著性变化(P>0.05),见图1。
2.2 添加不同浓度IAA对平菇菌丝干质量的影响
结果表明,不同浓度IAA对平菇菌丝干质量影响差异显著,与CK相比,添加高浓度的IAA溶液(10-3、10-5 mol·L-1)导致菌丝干质量极显著性降低(P<0.01),添加低浓度(10-12 mol·L-1)生长素溶液也导致菌丝干质量极显著性降低(P<0.01);但当添加生长素溶液为10-8 mol·L-1时,可极显著的增加菌丝干质量(P<0.01) ,结果见图2。
2.3 添加不同浓度IAA对平菇内源IAA的影响
结果表明,平菇菌丝体培养至第7天時,IAA含量最高,随后IAA含量开始下降,第15天时,与同时间段相比,当IAA浓度为10-3 mol·L-1时,IAA含量极显著性增加(P<0.01)至最高值,当IAA浓度为10-8 mol·L-1时,IAA含量极显著性降低(P<0.01)至最低值(图3)。高浓度IAA促进菌丝体期内源IAA的分泌,低浓度IAA抑制菌丝体期内源IAA的分泌。
2.4 添加不同浓度IAA对平菇菌丝IAA氧化酶活性的影响
试验结果表明,菌丝体培养至第7天时,IAA氧化酶活性最低,随后IAA氧化酶活性开始升高。同时间段相比,当IAA浓度为10-3 mol·L-1时,IAA氧化酶活性极显著性降低(P<0.01)至最低值,当IAA浓度为10-8 mol·L-1时,IAA氧化酶活性极显著性升高(P<0.01)至最高值(图4)。高浓度IAA抑制菌丝体期生长素氧化酶的活性,低浓度IAA促进菌丝体期生长素氧化酶的活性。
2.5 不同浓度IAA对平菇子实体发育的影响
试验结果表明(表1),与对照组相比,当生长素溶液的浓度为10-5 mol·L-1、10-8 mol·L-1、10-10 mol·L-1、10-12 mol·L-1时,均能够缩短平菇原基的形成时间,当添加10-8 mol·L-1IAA时,均可显著性的提高菇蕾数量(P<0.05),增加子实体产量,提高生物学效率;并且当喷洒浓度为10-8 mol·L-1的IAA溶液时,其原基形成时间可缩短至2 d以内,其菇蕾数量较对照组多24.23%,子实体产量及生物学效率较对照组提高了12.12%。
2.6 喷施不同浓度IAA对平菇子实体IAA含量的影响
试验结果表明,原基期IAA含量最低,随后开始升高,成熟期IAA含量(31.216 56±0.346 17 μg·g-1)最高,衰萎期IAA含量又开始下降。同时期相比,当IAA浓度为10-3 mol·L-1时,IAA含量极显著性增加(P<0.01)至最高值,当IAA浓度为10-8 mol·L-1时,IAA含量极显著性降低(P<0.01)至最低值(图5)。
2.7 喷施不同浓度IAA对平菇子实体IAA氧化酶活性的影响
结果表明,在原基期,IAA氧化酶活性最高(11.893 68±0.298 43 μmol·g-1·h-1),随后IAA氧化酶活性开始降低。同时间段相比,当IAA浓度为10-3 mol·L-1时,原基期IAA氧化酶活性极显著性降低(P<0.01)至最低值,当IAA浓度为10-8 mol·L-1时,原基期IAA氧化酶活性极显著性升高(P<0.01)至最高值(图6)。
3 结论与讨论
吲哚乙酸IAA 作为生长素中最重要的一种内源激素,参与植物发育的诸多过程,调控多种生理反应。长期研究表明,生长素被认为是调控子房发育形成果实的最主要激素[16],主要是因为生长素能够改变植物体内的营养物质分配,形成分配中心,从而促进果实的发育。随着果实的不断成熟,IAA含量不断发生着变化[17]。吲哚乙酸氧化酶(IAAO)是一种催化降解吲哚乙酸的酶,是IAA分解代谢的关键酶,在IAA 分解代谢过程中起着关键作用。吲哚乙酸氧化酶通过氧化分解IAA 而使其失活以此来调节植物体内的生长素水平,从而保持植物的正常生长发育,调节植物体的生长节律[18],Kieliszew[19]在黑松的生根过程中发现,IAAO活性升高,Bagatharia等[20]在菜豆的胚根生长过程中发现,体内IAAO活性的变化与根的伸长有密切关系。但是吲哚乙酸IAA含量及吲哚乙酸氧化酶IAAO活性在平菇菌丝体发育过程中的变化趋势及研究仍是未知的。本研究结果表明,在平菇生长发育过程中,随着平菇菌丝体及子實体发育的逐渐成熟,生长素氧化酶活性随生长素含量升高而降低,在发育初期(5 d,原基期),IAA含量较低,分别为30.554 47±0.298 43 μg·g-1,28.341 62±0.298 43 μg·g-1,IAA氧化酶活性分别为10.354 97±0.458 03 μmol·g-1·h-1,11.893 68±0.298 43 μmol·g-1·h-1;第7天及成熟期达到最高值,生长素含量分别达到30.554 47±0.298 43 μg·g-1,31.216 56±0.346 17 μg·g-1,IAA氧化酶活性降至最低,为8.258 83±0.253 90 μmol·g-1·h-1,6.587 45±0.546 17 μmol·g-1·h-1,主要由于菌丝生长至第7天时,平菇生长代谢旺盛,导致体内激素水平的升高,随着菌丝的逐渐成熟,菌丝体内生长素氧化酶活性有所提升,导致 IAA 含量会有所下降;子实体期,生长素含量一直增加,在衰萎期有所下降,主要是由于在子实体发育阶段,为了长成可食用的子实体,导致体内激素水平的升高,但在衰萎期有所下降,为进入下一生长发育期做准备,因此生长素氧化酶活性有所上升,生长素含量下降,此项研究结果与贺丹[21],徐盼盼[22]在牡丹生根过程中,根的原基诱导期IAAO活性及生长素含量变化结果相似。
当添加10-3 mol·L-1 外源IAA时,因受外界环境因子的胁迫,平菇P99整个生长发育时期受到抑制,通过生长素氧化酶活性的降低,增加内源生长素含量调节环境胁迫的影响,此时菌落直径、菌丝干质量、原基形成时间、菇蕾数量、子实体产量、生物学效率达到最低值,主要是高浓度生长素的处理打破了原有内源IAA较为稳定而平衡的状态,导致生长素氧化酶活性降低,从而使平菇体内生长素含量升高,抑制了平菇生长发育期的生理功能;当添加10-8 mol·L-1 外源IAA时,极显著的促进了生长发育整个时期,此时内源生长素极显著性的降低,生长素氧化酶活性极显著性的升高,菌落直径及菌丝干质量达到最高值,原基提前形成,菇蕾数量、子实体产量、生物学效率升高,主要是低浓度生长素的刺激,破坏体内 IAA 含量的平衡状态,导致IAA的含量减少而使生理功能受到促进,促进了菌丝的生长及原基提前形成。
根据本研究的结果,在菌丝体生长发育阶段,初期菌丝生长旺盛,内源生长素含量较高,随着菌丝培养时间的延长,激素水平降低,氧化酶活性有所升高,以备调节下一生长发育期;在子实体生长发育阶段,原基期生长缓慢,内源生长素含量较低,到形成成熟的子实体,生长素含量达到最高,衰萎期有所下降,氧化酶活性升高,进入下一生长发育时期。在实际生产应用中,可添加10-8 mol·L-1 外源IAA,缩短平菇菌丝体及子实体生长周期,实现农业及企业增产增收,提高社会经济效益。
参考文献:
[1]吕剑,喻景权.植物生长素的作用机制[J].植物生理学通讯,2004(5):624-628.
[2]苑博华,廖祥儒,郑晓洁,等.引噪乙酸在植物细胞中的代谢及其作用[J].生物学通报,2005,40(4):21-23.
[3]LJUNG K, HULL A K, CELENZA J, et al.Sites and regulation of auxin biosynthesis in Arabidopsis roots[J].The plant cell, 2005, 17(4): 1090-1104.
[4]STEPANOVA A N, ROBERTSON-HOYT J, YUN J, et al. TAA1-mediated auxin biosynthesis is essential for hormone crosstalk and plant development[J].Cell, 2008, 133(1): 177-191.
[5]TAO Yi, FERRER J L, LJUNG K, et al. Rapid synthesis of auxin via a new tryptophan-dependent pathway is required for shade avoidance in plants[J]. Cell, 2008, 133(1): 164-176.
[6]UCHIUMI T, OKAMOTO T.Rice fruit development is associated with an increased IAA content in pollinated ovaries[J]. Planta, 2010, 232(3): 579-592.
[7]ZHAO Yunde. Auxin biosynthesis and its role in plant development[J].Annual review of plant biology, 2010, 61: 49-64.
[8]LIU K, WANG J, LI H , et al. Identification, expression and IAA-Amide synthetase activity analysis of gretchen Hagen 3 in Papaya Fruit (Carica papaya L.) during postharvest process[J]. Frontiers in plant science, 2016, 7: 1555.
[9]JIA Haifeng, XIE Zhenqiang, WANG Chen, et al.Abscisic acid, sucrose, and auxin coordinately regulate berry ripening process of the Fujiminori grape[J]. Functional & integrative genomics, 2017, 17(4): 441-457.
[10]LIAO X, LI M, LIU B, et al. Interlinked regulatory loops of ABA catabolism and biosynthesis coordinate fruit growth and ripening in woodland strawberry[J]. Proceedings of the national academy of sciences of the United States of America, 2018, 115(49): E11542-E11550.
[11]趙艳萍,魏佳乐.生长素的生理作用研究[J].乡村科技,2019(9):102-103.
[12]吴尚军,贺国强.设施香菇 平菇实用栽培技术集锦[M].北京:中国农业出版社,2014.
[13]哈申吐力古尔,白福林. 平菇的生物学特性[J]. 内蒙古农业科技, 2009, 6: 79-80.
[14]张志良.植物生理学试验指导[M].北京:高等教育出版社,1993.
[15]张志良.植物生理学实验指导[M].第2版.北京:高等教育出版社,1990.
[16]PANDOLFINI T, MOLESINI B, SPENA A.Molecular dissection of the role of auxin in fruit initiation[J].Trends in plant science, 2007, 12(8): 327-329.
[17]BUTA J G, SPAULDING D W. Changes in indole-3-acetic acid and abscisic acid levels during tomato (Lycopersicon esculentum Mill.) fruit development and ripening[J]. Journal of plant growth regulation, 1994, 13(3): 163.
[18]陈其军,韩玉珍.高等植物性别表达的单激素调控模型[J].生命科学,1999(6):84-87.
[19]KIELISEZEW B.Effect of treating scots pine (Pinus sylvestris L.) seedlings with phytohorm one on the growth of the root system and on the peroxidase and IAA oxidase enzyme activities in roots[J]. Arbortum-Kornckie, 1989, 32: 207-219.
[20]BAGATHARIA S B, CHANDA S V.Changes in peroxidase and IAA oxidase activities during cell elongation in Phaseolus hypocotyls[J]. Acta physiologiae plantarum, 1998, 20(1): 9-13.
[21]贺丹.牡丹试管苗生根调控研究[D].郑州:河南农业大学,2009.
[22]徐盼盼.环境因子对牡丹试管苗生根的影响[D].郑州:河南农业大学,2011.
收稿日期:2020-06-23
基金项目:河南省农业科学院优秀青年科技基金计划项目(2020YQ18); 河南省现代农业产业技术体系专项资金资助项目(S2013-09);国家食用菌产业技术体系(CARS-20)
作者简介:崔筱(1983—),女,河南南阳人,助理研究员,博士,主要从事食用菌育种及功能基因研究。
通信作者简介:孔维丽(1976—),女,河南开封人,副研究员,硕士,主要从事食用菌育种及平菇发酵料栽培机理研究。
- 在学习中培养学生解决问题的能力
- 如何提高小学语文课堂的效率
- 初中语文拓展阅读教学分析
- 小学语文教学中激励性语言的运用方法分析
- 浅谈小学语文课堂提问的有效性
- 创设高中语文高效课堂的尝试
- 小学体育循环训练法的探讨
- 如何追寻感悟与诗意的和谐同构
- 让“交流平台”承载本原
- 小学语文“体悟式阅读”教学的探索
- 抓纲务本增强中考文言文复习的实效性
- 在语文教学中培养小学生快速阅读的能力
- 把阅读的主动权还给学生
- 民办高职院校应用文写作实效性教学存在问题及改革探究
- 培养创新能力?提高写作水平
- 从“新”开始解读作文
- 小学生写作能力培养对策分析
- 小学生作文初学指导新探
- 农村初中语文教师如何借助Moodle平台提升写作教学有效性
- 点燃孩子智慧的火花
- 阅读教学中的审丑
- 作文中的有效描写
- 谈谈观察中推进作文教学
- 点燃阅读激情,焕发语文课堂异彩
- 是“范进中举”?还是“众人中举”?
- perpetrations
- perpetrator
- perpetrators
- perpetuable
- perpetual
- perpetualinventory
- perpetualism
- perpetualist
- perpetualities
- perpetuality
- perpetually
- perpetualness
- perpetualnesses
- perpetuals
- perpetuance
- perpetuances
- perpetuate
- perpetuated
- perpetuates
- perpetuating
- perpetuation
- perpetuations
- perpetuative
- perpetuator
- perpetuators
- 违式
- 违式进谏
- 违强陵弱
- 违律
- 违德
- 违心
- 违心之言
- 违心之议
- 违心之论
- 违心地屈服
- 违心曲从以全社稷之计
- 违忌
- 违志
- 违忤
- 违忧
- 违怨
- 违恋
- 违恨
- 违悖
- 违患
- 违惰
- 违意
- 违慢
- 违戾
- 违才