袁启凤 李仕品 严佳文
摘要:通过了解紫红龙在不同温度条件下的生理特征,为延长其贮藏期限提供依据,以模拟常温(25±0.5) ℃和低温(5±0.5) ℃贮藏的紫红龙为试验材料,研究其采后在不同贮藏环境中可溶性蛋白质含量、抗氧化酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)]活性、丙二醛(MDA)含量和抗超氧阴离子(O-2·)活力等生理指标的变化。结果表明:低温比常温减缓了紫红龙果实可溶性蛋白质的分解,随着贮藏时间的延长,低温下SOD、CAT活性较常温下的高;在贮藏0~20 d,低温下的POD活性变化较常温的稳定,且从贮藏4 d开始,低温下的POD活性较常温条件下的高;MDA含量随着时间的变化呈先上升后下降的趋势,但在同一贮藏时间,低温下的MDA含量较常温的低。可见,低温处理能提高紫红龙SOD、CAT和POD活性,减轻MDA的积累,从而延缓紫红龙的衰老,延长贮藏期限。
关键词:火龙果;紫红龙;贮藏温度;采后生理;抗氧化酶活性
中图分类号: S667.909+.3;TS255.3 ?文献标志码: A ?文章编号:1002-1302(2019)02-0186-03
火龙果(Hylocereus undulatus Britt.)属仙人掌科(Cactaceae)量天尺属植物,原产于巴西、墨西哥等中美洲至南美洲热带地区,目前在我国贵州、海南、广西、广东、福建等地区被大量发展种植。贵州省于1996年引进火龙果进行试种,并选育出红皮红肉的紫红龙,紫红龙果实外观艳丽,呈红色,鳞片较直立,果肉甜酸适度,口感脆,营养丰富,年产5~6批次果实(6月中下旬至12月上旬)。目前紫红龙已成为贵州省精品水果产业“十二五”期间重点发展的树种,已在贵州南部红水河谷、南北盘江两岸被大量发展种植[1],截至2016年底,紫红龙种植面积已达7 333.3 hm2,产量也在逐年增加。但由于各主产区气候特点近似,因此產期相对集中,导致市场供过于求,再加上盛产期为夏季,正值高温季节,此期常温贮藏的果实容易腐烂。相关研究表明,传统简易常温贮藏紫火龙,贮藏期只有10 d左右[2]。为了缓解产业发展中存在的果品销售问题,延长果品销售期,减少采后果实在贮藏期间的损失,让果农获得更好的经济效益,火龙果产区新建或拟建相应的冷库,可以缓解集中上市、高温腐烂的问题。
低温贮藏是目前最有效的保鲜手段之一,在多种果蔬上已获得成功应用,其原理是随着温度的下降,各种微生物生长繁殖减慢,水果新陈代谢放缓,腐烂减轻,在气温较高的季节通过低温冷藏可延缓果实后熟衰老,并保证果实的长时间供应。王俊宁等对白玉龙火龙果在常温贮藏过程中抗氧化酶活性的研究表明,贮藏初期,总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)活性先下降,过氧化物酶(POD)活性缓慢上升,随后均迅速升高,达到最高峰后又呈下降趋势[3];王彬等的研究表明,对白肉火龙果晶红龙采用1-甲基环丙烯(1-MCP)熏蒸结合低温冷库(10±0.5) ℃处理,发现贮藏前期可延缓果实衰老,后期则加速衰老[4];张绿萍等对火龙果晶红龙和紫红龙的采后贮藏活性氧代谢规律的研究表明,具有清除H2O2能力的POD和CAT活性均呈先上升后下降的变化趋势[5];刘顺枝等对红皮白肉火龙果的贮藏研究表明,5 ℃贮藏较15 ℃延迟了果皮POD、SOD活性高峰,使CAT保持较高的活性,抑制了丙二醛(MDA)含量的增加,从而延缓衰老,延长贮藏期[6];玉新爱在常温和低温(10±1) ℃贮藏下采用复合涂膜处理火龙果的研究表明,复合涂膜结合低温能有效降低贮藏期间果皮的MDA含量,提高POD活性,延缓果实的衰老和腐烂[7]。根据前人报道的火龙果贮藏保鲜结果发现,对火龙果紫红龙的低温贮藏保鲜研究较少,为此,本试验以火龙果紫红龙为试验材料,主要从生理层面来研究紫红龙果实在常温(25±0.5) ℃和低温(5±0.5) ℃贮藏期间可溶性蛋白质、MDA含量和抗氧化酶活性等相关指标的变化,探讨生理指标变化与果实贮藏性的关系,为紫红龙的贮藏保鲜技术提供理论依据,也为进一步优化低温保鲜技术提供参考。
1 材料与方法
1.1 试验材料
紫红龙(Hylocereus undulatus ‘Zihonglong)果实采自贵州省果树科学研究所镇宁火龙果示范种植园。鲜果于2015年10月21日采收,采摘果实为九成熟,当天运回贵州省果树科学研究所果品贮藏与加工室验室,常温(15±3) ℃散热,于24 h后挑选大小均匀、无病虫害的果实用于试验。
1.2 试验设计
根据连龙浩等报道,5 ℃是火龙果的冷害临界温度和适宜的贮藏温度[8-9],综合越南火龙果低温冷藏温度保持在 4~8 ℃、湿度保持在85%~95%的报道[10],本试验选择贮藏温度为常温(25±0.5) ℃(空调房)和低温(5±0.5) ℃(恒温箱),环境的相对湿度为(80±5)%,自然裸放。常温处理120个果实,低温处理180个果实,从贮藏当天开始,每隔1 d对果皮和果肉分别进行取样,并用液氮速冻,用研磨机快速研磨后放置于-70 ℃超低温冰箱内保存备用。
1.3 测定项目与方法
本试验所有酶活性测定均采用试剂盒(购自南京建成生物工程研究所)。
1.3.1 可溶性蛋白质含量的测定 参照曹建康等的考马斯亮蓝法测定[11],称取1 g样品至4 mL pH值为7.0的磷酸缓冲液中,取样液0.15 mL加入考马斯亮蓝混匀放置5 min后,测定波长为595 nm处的吸光度。
1.3.2 总超氧化物歧化酶活性的测定 按照试剂盒组织样本质量(g) ∶ 体积(mL)=1 ∶ 9的比例,冰浴条件下称取 1.0 g 样品至4 mL pH值为7.0的磷酸缓冲液中,制备成组织匀浆,4 ℃、3 000 r/min离心10 min,取上清液0.1 mL按照试剂盒方法进行比色测定,以1 mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活性单位 (U/mg)。
1.3.3 丙二醛含量的测定 称取0.5 g样品至 4.5 mL 提取液(pH值为7.0的磷酸缓冲液)中,取0.03 mL样液按照试剂盒方法进行比色测定(单位为nmol/mg)。
1.3.4 过氧化物酶活性的测定 按照试剂盒组织样本质量(g) ∶ 体积(mL)=1 ∶ 9的比例,冰浴条件下,称取0.5 g样品至4.5 mL提取液(pH 值为7.0的磷酸缓冲液)中,制备成组织匀浆,4 ℃、3 500 r/min离心10 min,取上清液0.1 mL按照试剂盒方法进行比色测定,以1 mg组织蛋白1 min内催化 1 μg 底物的酶量为1个活性单位(U/mg)。
1.3.5 过氧化氢酶活性的测定 按照试剂盒组织样本质量(g) ∶ 体积(mL)=1 ∶ 9的比例,冰浴条件下,称取0.5 g样品至4.5 mL提取液(pH值为7.0的磷酸缓冲液)中,制备成组织匀浆,4 ℃、2 500 r/min离心10 min,取上清液0.05 mL按照试剂盒方法进行比色测定,以1 mg组织蛋白1 s分解 1 μmol H2O2的量为1个活性单位 (U/mg)。
1.3.6 超氧阴离子(O-2·)含量的测定 按照试剂盒组织样本质量(g) ∶ 体积(mL)=1 ∶ 9的比例,冰浴条件下,称取0.5 g样品用4.5 mL pH值为7.0的磷酸缓冲液制备成组织匀浆,4 ℃、8 000 r/min离心10 min,取上清0.05 mL按照试剂盒方法进行比色测定,以1 g组织蛋白在37 ℃反应40 min所抑制的超氧阴离子自由基相当于1 mg维生素C所抑制的超氧阴离子自由基的变化值为1个活性单位(U/g)。
1.4 数据统计分析
采用Excel 2003计算平均值、标准差和制图;方差分析用SPSS 17.0专业统计软件,用邓肯氏多重比较法检验其差异显著性(α=0.05)。
2 结果与分析
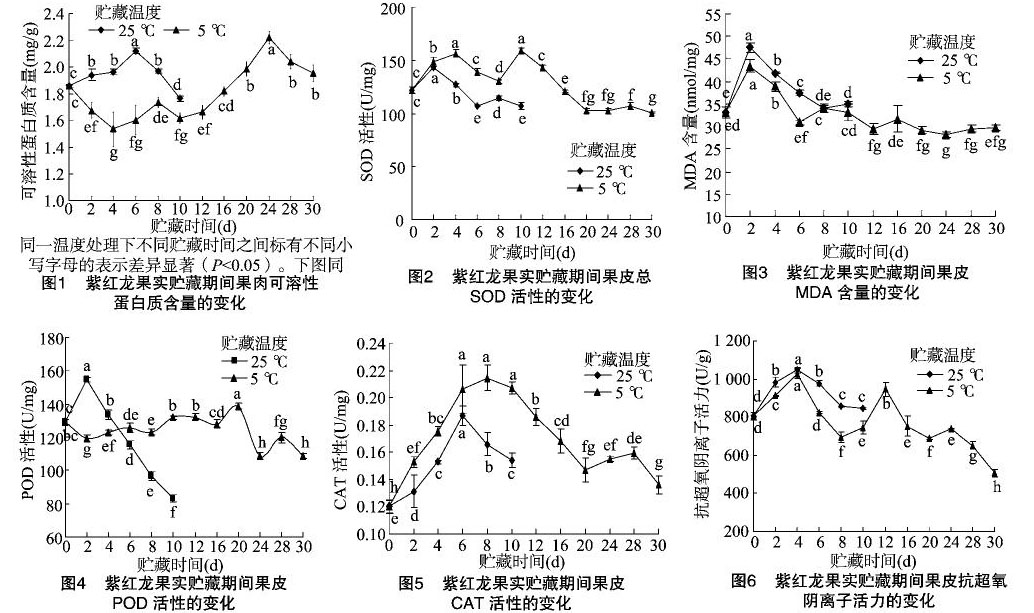
2.1 紫红龙果实采后贮藏期间可溶性蛋白质含量的变化
由图1可知,紫红龙果实的可溶性蛋白质含量在常温 25 ℃ 和低温5 ℃贮藏下的变化趋势相反。其中,常温25 ℃贮藏期间的可溶性蛋白质含量与贮藏初期差异显著,贮藏至6 d时可溶性蛋白质含量达最大值,为2.12 mg/g,之后下降至贮藏结束;在低温5 ℃贮藏条件下,贮藏的2~4 d可溶性蛋白质含量下降,均显著低于贮藏初期,从贮藏6 d开始至 24 d,可溶性蛋白质含量整体呈上升趋势,24 d时达最大值,为1.95 mg/g,随后又呈下降趋势直至贮藏结束。
2.2 紫红龙果实采后贮藏期间SOD活性的变化
由图2可知,紫红龙果皮的SOD活性在不同贮藏方式下首先表现为先上升后下降的趋势,其中在常温25 ℃条件下,贮藏2 d时,SOD达到活性峰值,为143.10 U/mg,显著高于贮藏初期,随着贮藏时间的延长,SOD活性开始下降,贮藏 6 d 时,SOD活性下降至最低值,为97.57 U/mg,且显著低于贮藏初期的SOD活性,之后贮藏至8 d时,SOD有小幅度上升,但仍显著低于初期的SOD活性,随后下降至果实腐烂;在低温5 ℃贮藏条件下,贮藏4 d(156.68 U/mg)和10 d(158.88 U/mg)时,SOD活性有2次峰值,并且在贮藏至12 d后SOD活性才显著低于贮藏初期,随后仍在下降,自20 d到贮藏结束,SOD活性均显著低于贮藏初期值,但贮藏后20~30 d的SOD活性变化不大。
2.3 紫红龙果实采后贮藏期间MDA含量的变化
由图3可知,在常温25 ℃和低温5 ℃贮藏环境下,紫红龙果皮的MDA含量在一定范围内呈先上升后下降再上升的趋势,其中常温25 ℃贮藏2 d时已达最大值,为47.49 nmol/mg,显著高于贮藏各个时期的MDA含量,之后随贮藏时间的延长而迅速下降,至贮藏8 d时已降至最低值,为34.10 nmol/mg,但与初期的MDA含量差异不显著,贮藏10 d时,MDA含量再次上升,为35.06 nmol/mg,高于贮藏初期;在低温5 ℃条件下,贮藏2 d时MDA含量达最大值,为43.36 nmol/mg,同样是显著高于贮藏各时期的MDA含量,自2 d后开始下降,到 6 d 时已降至30.88 nmol/mg,显著低于初期MDA含量,随后MDA含量又呈上升—下降趋势,16 d后至贮藏结束MDA含量均显著低于贮藏初期,并维持在一定水平至腐烂。
2.4 紫红龙果实采后贮藏期间POD活性的变化
由图4可知,紫红龙果皮的POD活性在常温25 ℃下呈先上升后下降趋势,贮藏2 d时POD活性上升至最高值,为154.57 U/mg,显著高于初期的活性,之后活性开始逐渐下降,至10 d时降至83.08 U/mg,显著低于初期的活性;在低温5 ℃下整体上呈先下降后上升再下降的趋势,贮藏2 d时POD活性降至相对较低值,为119.52 U/mg,之后呈上升趋势,至12 d时(132.28 U/mg),POD活性又高于贮藏初期,但差异不显著,至20 d时升至高峰,为138.59 U/mg,显著高于初期,之后直至贮藏结束仍处于下降趋势。
2.5 紫红龙果实采后贮藏期间CAT活性的变化
由图5可知,紫红龙果皮的CAT活性在25 ℃常温贮藏下,随着贮藏时间的延长呈先上升后下降趋势,贮藏6 d时达最大值,为0.186 U/mg,显著高于初期,之后CAT活性下降至
贮藏结束,但仍显著高于贮藏初期的活性;在5 ℃低温下果皮CAT活性在一定范围内先升高后下降,贮藏至2~8 d时CAT活性一直呈升高趋势,至8 d时达到最大值,為0.214 U/mg,之后随贮藏时间的延长呈下降趋势,但仍显著高于初期的活性。
2.6 紫红龙果实采后贮藏期间抗超氧阴离子活力的变化
由图6可知,紫红龙果皮中抗超氧阴离子活力在常温 25 ℃ 和低温5 ℃贮藏下,整体呈先上升后下降的趋势,其中在常温贮藏下,整个贮藏期的抗超氧阴离子活力均显著高于贮藏初期,贮藏2~4 d时抗 O-2 · ?活力一直呈升高趋势,至4 d时达最大值,为1 096.09 U/g,之后随着贮藏时间的延长呈下降趋势;在低温贮藏下,贮藏至2~4 d时抗超氧阴离子活力也呈升高趋势,至4 d达最大值,为1 028.40 U/g,至6 d时又呈下降趋势,至8 d时降至695.93 U/g,随后上升,至12 d时又上升至较大值,为994.50 U/g,之后整体呈下降趋势至腐烂,均显著低于贮藏初期的值。
3 讨论与结论
果蔬在正常的生理情况下其体内清除活性氧的保护酶如SOD、CAT和POD等会相互协调共同组成酶促防御系统,及时清除体内不断产生的活性氧,保持正常的生理代谢,从而处于动态平衡[12]。但随着对果实进行不同的胁迫处理和果实的成熟衰老,体内细胞会产生不同程度的变化,从而影响酶活性[13-15]。本试验结果表明:在常温和低温5 ℃贮藏下,贮藏前期的紫红龙果皮SOD活性、清除 O-2 · ?活力、MDA含量呈上升趋势,说明贮藏前期紫红龙果皮受到不同处理刺激激活了自身防御系统,促进次生代谢物的产生,从而提高了SOD和POD活性,但此时CAT活性受到刺激后还处于较低水平,直接清除 O-2 · ?的能力还较低,随着贮藏时间的延长果实体内又不断产生有害物质,从而导致MDA含量增加。在贮藏后期,紫红龙果皮的SOD、CAT和POD活性开始降低,清除 O-2 · ?活力下降,MDA含量趋于平缓,说明贮藏后期紫红龙果皮内产生的抗氧化酶活性还能清除 O-2 · ?,故MDA含量相对较低。可见,低温处理紫红龙后,减轻了MDA的积累,可及时清除体内产生的 O-2 · ?,从而延缓紫红龙的衰老,延长贮藏期限。
温度是影响果实代谢过程、品质与贮藏寿命的重要因子。果蔬采摘后,由于其新陈代谢活动仍然存在,其体内的代谢平衡就会受到不同环境条件的影响,从而影响果实内含物,甚至失去经济价值。王生有用双层薄膜包裹火龙果并在8、25 ℃贮藏的研究表明,可溶性蛋白质含量在不同温度下的变化趋势相反[16],与本试验研究结果一致,说明低温能够有效地延缓可溶性蛋白质的分解速度,至于贮藏后期可溶性蛋白质含量升高,这是否与长期的贮藏导致营养物质转化从而延长贮藏期有关还有待进一步研究。
以上结果表明:紫红龙在低温5 ℃下贮藏较常温增加 20 d,并且贮藏期间其可溶性蛋白质分解速度较常温相对缓慢,其3种重要的抗氧化酶(SOD、POD、CAT)能有效地清除各种活性氧,从而防止活性氧对细胞膜系统的损坏,延缓果实衰老进程,从而延长贮藏期。但这种单一的保鲜技术也存在不足,今后还须协同如臭氧处理、套袋和涂漠等方式,实现更低成本,获取更高效益,以应对紫红龙的贮藏保鲜。
参考文献:
[1]王 彬,郑 伟,宋 莎,等. 紫红龙火龙果及其大果型芽变系的ISSR分析[J]. 西南农业学报,2013,26(4):1614-1617.
[2]王 彬,郑 伟,彭玉基. 火龙果果实常温贮藏性能研究[J]. 江苏农业科学,2009(2):217-219.
[3]王俊宁,邹 梦,李润唐,等. 火龙果贮藏过程中活性氧代谢研究[J]. 江苏农业科学,2011,39(5):383-384.
[4]王 彬,郑 伟,何绪晓,等. 1-MCP对火龙果果实采后生理特性的影响[J]. 西南农业学报,2011,24(6):2127-2131.
[5]张绿萍,金吉林,邓仁菊. 火龙果采后贮藏品质变化及活性氧代谢规律[J]. 南方农业学报,2012,43(4):506-510.
[6]刘顺枝,孙 茹,江月玲,等. 贮藏温度对火龙果品质和衰老变化的影响[J]. 食品科学,2013,34(12):336-340.
[7]玉新爱. 涂膜保鲜剂对火龙果贮藏品质及生理生化变化的影响[D]. 南宁:广西大学,2015:42-43.
[8]连龙浩. 火龙果最适贮藏条件及其冷害发生机制研究[D]. 福州:福建农林大学,2014:11-24.
[9]张丽丽,沈佳鑫,曹晶晶,等. 不同贮藏温度下红心火龙果的品质变化[J]. 山西农业科学,2013,41(12):1385-1387,1390.
[10]de Freitas S T,Mitcham E J. Quality of pitaya fruit (Hylocereus undatus) as influenced by storage temperature and packaging[J]. Scientia Agricola,2013,70(4):257-262.
[11]曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导 [M]. 北京:中国轻工业出版社,2007:67-68.
[12]杜秀敏,殷文璇,赵彦修,等. 植物中活性氧的产生及清除机制[J]. 生物工程学报,2001,17(2):121-125.
[13]Liaotrakoon W,de Clercq N,Van Hoed V,et al. Erratum to:impact of thermal treatment on physicochemical,antioxidative and rheological properties of White-Flesh and Red-Flesh dragon fruit (Hylocereus spp.) purees[J]. Food and Bioprocess Technology,2013,6(5):1365.
[14]任文彬,黎铭慧. L-半胱氨酸与壳聚糖复合处理对鲜切火龙果贮藏效果的影响[J]. 食品科学,2013,34(18):317-320.
[15]Foyer C H,López-Delgado H A,Dat J,et al. Hydrogen peroxide and glutathione associated mechanisms of acclamatory stress to tolerance and signaling[J]. Physiologia Plantarum 100(2):241-254.
[16]王生有. 高氧氣调包装对火龙果采后生理及品质的影响[D]. 南昌:江西农业大学,2014:16-20.
- 浅谈初中英语课堂的几种导入方法
- 提高学习兴趣 构建英语有效课堂
- 培养高中生的英语口语交际能力的策略探究
- 浅谈高中英语的“大阅读”教学方法
- 初中英语教学反思
- 论小组合作学习法在高中英语教学中的应用
- 初中英语教学中情感因素的作用
- 浅谈如何提高农村学生的英语口语能力
- 简析情境教学法应用于高中英语语法教学中的效果
- 试析我国英语新课改的意义和方法
- 在英语教学中培养学生的思维能力
- 论任务型教学模式在高中阅读教学中的应用
- 高中英语反思性教学初探
- 提高学生语言运用能力的策略思考
- 英语课堂怎样培养学生的能力
- 浅议学生自我学习意识在英语教学中的培养
- 初中英语教学生活化探究
- 在《牛津高中英语》教学中实施课题研究性学习
- 浅谈情境教学法在英语教学中的运用
- 如何高效开展初中英语综合实践课
- 试论课程改革背景下高中英语教学的思考
- “反问法”上英语阅读课
- 译林版初中英语口语教学初探
- 高中英语自主性学习策略指导
- 英语课堂教学有效性缺失的原因分析及对策
- put your arms around
- put your feet up
- put your foot down
- put your foot in it
- put your hand in your pocket
- put your hands together
- put your hand up
- put your heads together
- put yourself in sb's place
- put yourself out
- put yourself/sb forward
- reciprocity
- recircled
- recircles
- recircling
- recirculated
- recirculates
- recirculating
- recirculation's
- recirculations
- recitable
- recital
- recitalist
- recitalists
- recitalists'
- 水流广大众多的样子
- 水流广大的样子
- 水流广阔洪大的样子
- 水流广阔浩大的样子
- 水流弯曲的地方
- 水流急
- 水流急溅的样子
- 水流急而回旋
- 水流急速地往下流
- 水流悠长
- 水流旋转的样子
- 水流汹涌
- 水流汹涌、暴雨等声
- 水流汹涌不止
- 水流汹涌的样子
- 水流泻
- 水流清澈
- 水流清澈的样子
- 水流湍急、崖岸峻险的地方
- 水流湍急的样子
- 水流湍急的渡口
- 水流湿,火就燥
- 水流溢,泛滥
- 水流满的样子
- 水流激荡