魏冬梅 段魏魏 陈真 王咏星


摘要:在对新疆五家渠地区15株鱼类水霉病病原菌18S rDNA克隆测序的基础上,探讨相比传统分类方法,运用18S rDNA序列进行分子鉴定对水霉菌分类的可行性。结果显示,用MEGA 5.0软件构建邻接(NJ)树和最大似然(ML)树进行分类,15株病原菌中LF04、LF01、JX03、JX01为寄生水霉,HL04、JY07、HZ、JY10、LY04、JY15、HL01为镰刀菌,JX02为腐霉,JY06未鉴定出结果,与形态学分类结果差异巨大。
关键词:水霉病;系统发育树;分类;18S rDNA
中图分类号: S941.43+1
文献标志码: A
文章编号:1002-1302(2019)15-0194-06
水霉病(saprolegniasis)又称肤霉病、白毛病,是威胁淡水鱼类养殖的世界性病害,在很多淡水鱼的成鱼、鱼苗、鱼卵中都会发病。水霉病的病原目前已发现有几十种,主要是真菌门鞭毛菌亚门藻状菌纲水霉目水霉科的水霉属和绵霉属以及霜霉目腐霉科的腐霉属和疫霉属[1-3],宿主一般在受伤之后易感染水霉病[4]。水霉病病原菌通常具有一些真菌特征,但其作为非真菌的类真菌生物,对于其分类地位尚存争议[5]。目前,随着分子生物学的快速发展,许多分子生物学手段已用于水霉的分类学研究[6-10]。内转录间隔区(ITS)区域与18S rDNA因其高度保守且种间甚至种内高度变异被广泛应用于真菌种间分析和种的鉴定。新疆独特的气候特点使鱼类在经历严冬后的初春易患水霉病,鱼类水霉病的病情较我国其他地区更为严峻,而目前未见相关研究,因此对新疆地区鱼类水霉病病原菌的分离鉴定十分必要。
对于初学者而言,构建邻接(NJ)树和最大似然(ML)树,一般采用MEGA软件[11]。MEGA是Nei开发并设计的图形化软件,使用方便快捷。本研究以新疆五家渠地区分离纯化所得15株水霉病病原菌18S rDNA区域为分子标记,进行分子生物学鉴定,并与形态学的鉴定结果作对比,以期弥补国内水霉分类研究的不足,并为鱼类水霉病的病原鉴定及后期药物防治的研究提供数据。
1 材料与方法
1.1 试验材料
菌种:由笔者所在实验室早期分离纯化(于2010—2017年自新疆五家渠市水产养殖基地采样,带回实验室分离纯化菌种并进行形态、18S rDNA测序分析等相关试验)获得并进行形态学初步鉴定。其中,HL01、HL02和HL04分离自新疆五家渠患病河鲈鱼病灶处,HZ、HZ02分离自新疆五家渠患病虹鳟鱼病灶处,JX01、JX02、JX03分离自新疆五家渠患病江雪鱼病灶处,JY06、JY07、JY10、JY15分离自新疆五家渠患病鲫鱼病灶处,LF01、LF04分离自新疆五家渠患病罗非鱼病灶处,LY04分离自新疆五家渠患病鲢鱼病灶处。
1.2 方法
1.2.1 菌株的活化 从长满水霉菌丝的平板上切取直径为 1 cm 的水霉琼脂块接种于水霉培养基平板中央,25 ℃培养 3~4 d。
1.2.2 DNA提取及PCR扩增 采用十六烷基三甲基溴化铵(CTAB)裂解法提取基因组DNA[12],利用1%琼脂糖凝胶分离PCR产物。将分离的PCR产物与病原菌送至生工生物工程(上海)股份有限公司进行测序。
1.2.3 序列比对及遗传距离分析 序列采用Sequencing Analysis 5.2(Applied Biosystems)软件反复进行校对,去除两端不确定的序列后,在GenBank中进行BLAST比较搜索,同时下载同源性序列。采用Clustal X 2.1对所选序列进行比对。采用MEGA 5.0 1软件中的Kimura雙参数模型计算种间的遗传距离。
1.2.4 MEGA 5.0系统进化树的构建 在GenBank中进行BLAST比较搜索,下载同源性序列,用MEGA 5.0软件构建 Neighbour-Joining(NJ) 树和Maximum Likelihood(ML) 树,自举值(Bootstrap)分析均采用1 000次重复抽样。
2 结果与分析
2.1 18S rDNA PCR与测序结果
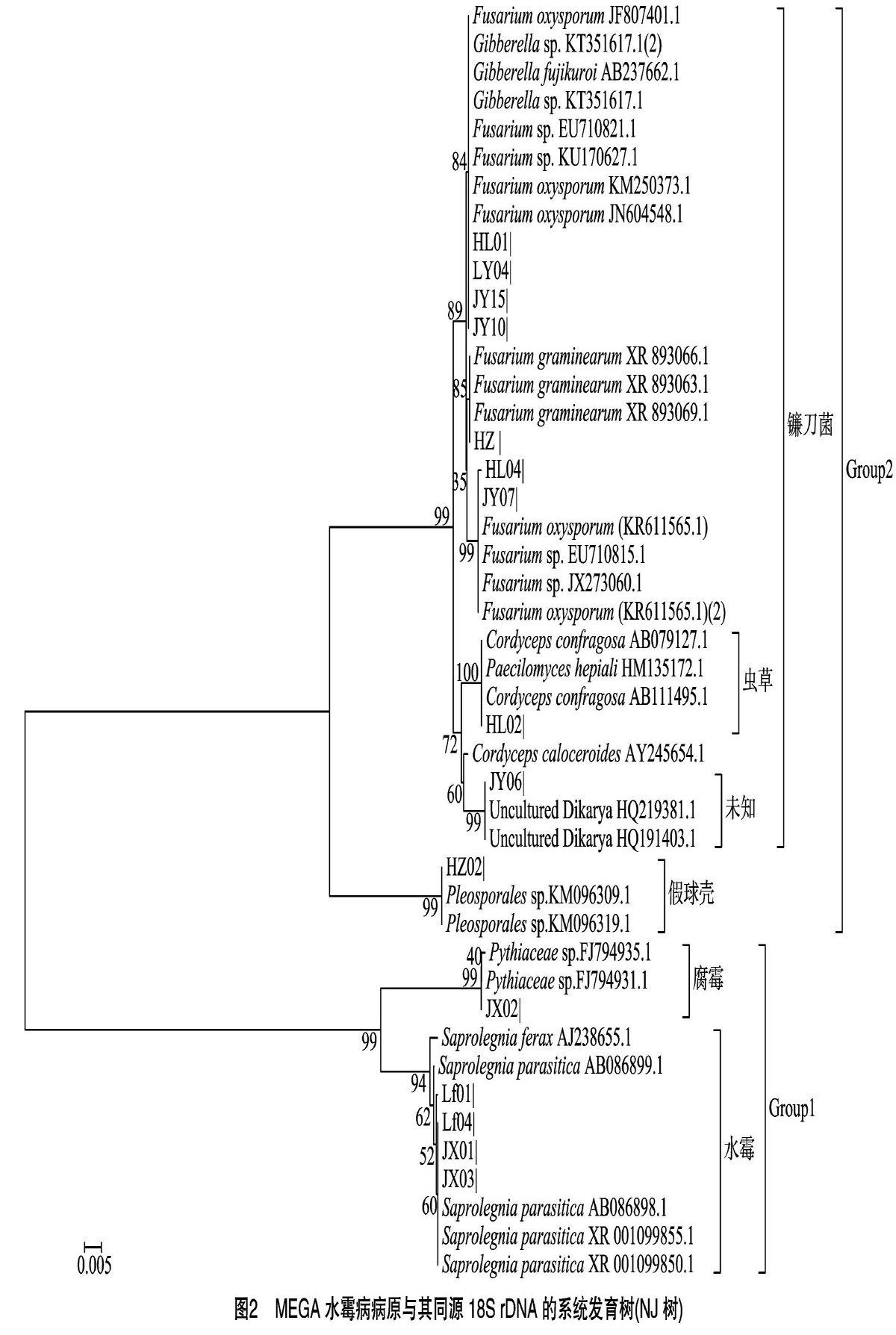
所得水霉病病原菌18S rDNA PCR琼脂糖凝胶电泳图谱见图1。结果显示,测序得到的序列大小在1 300~1 400 bp 之间,在美国国立生物技术信息中心(NCBI)数据库中,用所得序列进行BLAST比较搜索,得到其同源序列,本研究中其他30条BLAST序列的GenBank登录号如下:Fusarium graminearum(XR_893069.1)、Fusarium graminearum(XR_893066.1)、Fusarium graminearum(XR_893063.1)、Fusarium oxysporum(KR611565.1)、Fusarium oxysporum(JN604548.1)、Fusarium oxysporum(KM250373.1)、Fusarium oxysporum(JF807401.1)、Fusarium oxysporum(KR611565.1)、Fusarium sp. (EU710815.1)、Fusarium sp.(KU170627.1)、Fusarium sp. (JX273060.1)、Fusarium sp.(EU710821.1)、Gibberella sp.(KT351617.1)、Gibberella sp.(KT351617.1)、Gibberella fujikuroi(AB237662.1)、Cordyceps confragosa(AB111495.1)、Cordyceps confragosa(AB079127.1)、Cordyceps caloceroides(AY245654.1)、Pythiaceae sp.(FJ794931.1)、Pythiaceae sp.(FJ794935.1)、Paecilomyces hepiali(HM135172.1)、Pleosporales sp.(KM096319.1)、Pleosporales sp.(KM096309.1)、Saprolegnia parasitica(AB086898.1)、Saprolegnia parasitica(AB086899.1)、Saprolegnia parasitica(XR_001099855.1)、Saprolegnia parasitica(XR_001099850.1)、Saprolegnia ferax(AJ238655.1)、Uncultured Dikarya(HQ219381.1)、Uncultured Dikarya(HQ191403.1)。
2.2 18S rDNA序列的遗传距离分析
采用MEGA 5.0 1软件中的Kimura双参数模型计算种间的遗传距离。由表1可知,LF01、LF04、JX01、JX03这4 株菌与Saprolegnia parasitica(寄生水霉)菌株的遗传距离最近在0.000~0.002之间;JY07、JY10、JY15、HZ、LY04、HL01、HL04等7株菌与Fusarium oxysporum(尖孢镰刀菌)和Fusarium graminearum(禾谷镰刀菌)的遗传距离最近在0.001~0.006之间;JX02与Pythiaceae sp.(腐霉)的遗传距离最近在 0.000~0.001之间。
2.3 MEGA 5.0软件序列及系统发育分析
将NCBI数据库BLAST得到的同源序列用MEGA 5.0构建Neighbour-Joining树和Maximum Likelihood树,由图2、图3可知,运用MEGA 5.0软件构建的NJ树和ML树,因2种算法差异,使2种树在遗传距离和小的聚群排列上有细微不同。但在大的聚类上,都可以将15株菌株分为2个大的聚群,根据大聚群分枝,15株菌大致分成了5类结果。由表2可知,LF01、LF04、JX01和JX03聚类在鞭毛菌门卵菌纲水霉目水霉科水霉属的寄生水霉;HZ、JY15、LY04、HL01、JY07、HL04和JY10聚类在子囊菌亚门肉座菌科赤霉属的尖孢镰刀菌或禾谷镰刀菌;JX02聚类在鞭毛菌门卵菌纲霜霉目腐霉科腐霉属腐霉;HL02聚类在虫草科;JY06未知。
2.4 15株菌18S rDNA序列比对与形态学鉴定结果比较
查阅笔者所在实验室前期工作总结《新疆五家渠水霉病原菌多样性的初步研究》与《鱼类水霉病原真菌的分离筛选》形态分类鉴定结果[13-14],与18S rDNA序列分类鉴定结果进行比较,由表3可见,2种分类方法结果差异明显。除LF01、LF04、JX01、JX03这4株菌都被分在水霉属外,其余菌均不在同一属,甚至科、目都不相同。
3 讨论
依据传统分类学标准,水霉属鉴定主要依据第1代游动孢子的释放模式,种的鉴定则要求对藏卵器、雄器及卵孢子分化位置及数目等有性器官作详细的描述[15]。水霉的生活史复杂,进一步提升了对其分类的难度[16],且很多从鱼体病灶处分离纯化的水霉,通常在实验室培养条件下不能或很难形成有性器官,有些种的有性器官在不同的生活环境中形状不稳定[17-19]。因此,应用传统的分类学标准很难甚至无法将病灶处水霉鉴定到种的水平。本研究中所用的15株菌,在形态观察的培养过程中发现,在不同的培养基,或相同培养基不同温度、不同pH值等条件下培养时,其菌落特征及无性形态特征均有差异。在对15株菌进行形态鉴定的过程中发现,水霉科的属特征与毛霉科、半知菌类的一些特征存在交叉,在形态鉴定时不能完全确定为哪个属,因为这些菌是在患水霉病的鱼体中分离获得的,最终按水霉科来进行形态分类,故形态分类结果可能存在偏差。再者水霉病的病原种类繁多,其病原范围可能更广。
对于水霉菌的分子鉴定,国内外研究也较少,从而使数据库数据量较少,无法从数据库中得到足够数据,故搜索到的同源序列大多为其他种属序列, 导致在分子分类分析时出现偏差。真菌全基因組GC含量具有种间特异性,但由于测序分
析的困难,故一般选用18S rDNA或ITS rDNA作分子分类分析,这种分类本身也存在一些偏差。综上,导致形态分类结果与分子分类结果差异巨大。
参考文献:
[1]Bruno D W,West P V,Beakes G W,et al. Saprolegnia and other Oomycetes[M]//Woo P T K,Bruno D W. Fish diseases & disorders. Wallingford,UK:CABI Inter national,2011.
[2]王立宝,刘文霞,左万星,等. 松萝酸对3种水霉病致病菌的抑菌作用[J]. 河北师范大学学报(自然科学版),2017,41(4):354-357.
[3]Yang H L,Ou R J,Cao H P,et al. Morphological characteristics and ITS rDNA region of a pathogenic Saprolegnia sp. isolate from Carassius auratus Gibelio eggs[C]. Chinese Society of Fisheries Society of 2011,2011.
[4]孟思妤,孟长明,陈昌福. 鱼类水霉病的发生原因与预防措施[J]. 渔业致富指南,2016(15):60-61.
[5]Tampieri M P,Galuppi R,Carelle M S,et al. Effectof selected essential oils andpure compounds on Saprolegnia parasitica[J]. Pharmceutical Biology,2003,41(8):584-591.
[6]Whisler H C. Identification of Saprolegnia spp. pathogenic in chinook salmon:final report[R]. Washington,D C:U S Department of Energy,1996.
[7]Dieguezuribeondo J,Cerenius L,Soderhall K. Physiological characterization of Saprolegnia parasitica isolates from brown trout[J]. Aquaculture,1996,140(3):247-257.
[8]陈剑山,郑服丛. ITS序列分析在真菌分类鉴定中的应用[J]. 安徽农业科学,2007,35(13):3785-3786,3792.
[9]Dieguez-Uribeondo J,Fregeneda-Grandes J M,Cerenius L,et al. Re-evaluation of the enigmatic species complex Saprolegnia diclina-Saprolegnia parasitica based on morphological,physiological and molecular data[J]. Fungal Genetics and Biology,2007,44(7):585-601.
[10]Paul B,Steciow M M. Saprolegnia multispora,a new oomycete isolated from water samples taken in a river in the Burgundian region of France.FEMS[J]. Microbiology Letters,2004,237(2):393-398.
[11]Kumar S,Tamura K,Nei M. MEGA3:integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics,2004,5(2):150-163.
[12]可小麗,汪建国,顾泽茂,等. 水霉菌总DNA提取方法研究[J]. 水生生物学报,2008,32(1):68-73.
[13]熊 刚,黄奕童,王咏星. 新疆五家渠水霉病原菌多样性的初步研究[C] // 第九届全国微生物学青年学者学术研讨会论文集,武汉,2012.
[14]熊 刚,尹思璐,梁永增,等. 河鲈水霉病病原菌的研究[J]. 安徽农业科学,2013,41(8):3411-3413,3439.
[15]可小丽,汪建国,顾泽茂,等. 水霉菌的形态及ITS区分子鉴定[J]. 水生生物学报,2010,34(2):293-301.
[16]余永年. 卵菌的系统学和分类学[J]. 武汉植物学研究,1986,4(4):399-410.
[17]Hatai K,Willoughby L G,Beakes G W. Some characteristics of saprolegnia obtained from fish hatcheries in Japan[J]. Mycological Research,1990,94(2):182-190.
[18]Leclerc M C,Guillot J,Deville M. Taxonomic and phylogenetic analysis of Saprolegniaceae (Oomycetes)inferred from LSU rDNA and ITS sequence comparisons[J]. Antonie Van Leeuwenhoek,2000,77(4):369-377.
[19]Seymour R L. The genus Saprolegnia[J]. Nova Hedwigia,1970,19(3):1-124.蒋 溥,王竞儒,王庆奎,等. 抗肉桂醛益生菌的筛选、鉴定和益生特性评价[J]. 江苏农业科学,2019,47(15):200-205.
- 论宪法信仰
- 经济法的社会责任原则分析
- 宪法的权威和生命力在于执行
- 宪法和法律委员会的宪法保障职能研究
- 英国脱欧的法律影响分析
- 形成法律信仰的若干思考
- 发展面向现代化的社会主义文化研究
- 中西法治文化差异
- 爱德华·柯克的普通法思想及对“法治中国”的启示
- 刑事专家辅助人制度存在意义研究
- 知识产权相关的不正当竞争行为及其规制
- 环境公益诉讼背景下的行政赔偿责任与民事侵权责任之竞合与处理规则探索
- 恶意民事诉讼的法律规制
- 浅议我国个人信用制度建设的现状、原因与解决路径
- 浅谈离婚损害赔偿制度
- 浅谈入室盗窃案件勘查中现场保护机制的构建
- 论私家侦探制度在中国的可行性
- 《快递暂行条例》研究
- 我国家庭教育立法研究述评
- 加快军民融合下国民经济动员立法的意义
- 论理工科高职学生法律素养提升的对策
- 高职院校师生共同体构建路径研究
- “互联网+”环境下高职院校法理学课程实践教学研究
- “教、学、练、战”教学模式下公安专业刑法课程教学改革研究
- 本科高校会计专业经济法学教学内容困境与选择
- discourages
- discouraging
- discouragingly
- discourse
- discoursed
- discourser
- discoursers
- discourses
- discourse's
- discoursing
- discourt
- discourteous
- discourteously
- discourteousness
- discourteousnesses
- discourtesy's
- discovenant
- discover
- discoverability
- discoverably
- discovered
- discoverer
- discoveries
- discovering
- discovers
- 惊逼
- 惊遁
- 惊遽
- 惊避
- 惊鄂
- 惊醒
- 惊醒睡梦
- 惊醒睡眠
- 惊采绝艳
- 惊镳
- 惊门
- 惊闹
- 惊闺
- 惊闻作古,悲痛万分
- 惊闻噩耗,抱痛不已
- 惊闻鹤
- 惊险
- 惊险小说
- 惊险片
- 惊险的巨浪
- 惊雁
- 惊雁怯弦
- 惊雁落空弦
- 惊雷
- 惊雷掣电