王丽丽 孙昌法 胡尚连
摘要: 以梁山慈竹为材料,提取叶片DNA并将其作为模板,采用正交设计试验优化影响梁山慈竹简单重复序列-聚合酶链式反应(SSR-PCR)体系的3个主要因素,并对21个梁山慈竹不同品系进行稳定性验证,结果表明,优化的20 μL SSR-PCR反应体系为2×Taq PCRMix 8 μL、模板DNA(20 ng/μL) 2.5μL 、SSR引物(1.0×10-4 mmol/L) 1 μL,無菌蒸馏水补足至20 μL;使用SSR引物BMK.38757对21个梁山慈竹不同品系进行扩增,扩增产物大小在 140 bp 左右,共有4个多态性位点;使用SSR引物L6、R83对梁山慈竹进行扩增,均获得3个多态性位点,且条带清晰。
关键词: 梁山慈竹;简单重复序列(SSR);聚合酶链式反应(PCR);正交试验;优化
中图分类号:S795.501? 文献标志码: A
文章编号:1002-1302(2020)05-0061-04
简单重复序列(simple sequence repeats,SSR)别称微卫星DNA(microsatellite DNA)[1],由1~6个碱基重复串联组成,其不同等位基因间的重复数具有丰富的差异,而其两侧的序列高度保守,可以在重复串联序列的两端设计引物,通过聚合酶链式反应(PCR)扩增片段的长度检测等位基因的多态性。SSR是Skinner等于1974年在研究寄居蟹时首次发现的[2],此后人们相继发现,SSR广泛存在于真核生物中,由于其具有多态性高、容易检测、共显性等特点,SSR标记技术很快在动植物遗传检测分析中得到广泛应用[3-4]。
SSR标记根据开发方法可分为基因组SSR(gSSR)、表达序列标签SSR(EST-SSR)标记,随着高通量测序技术的发展,转录组测序相对价格越来越低,一些无参照基因组物种的EST-SSR开发也越来越容易。西南科技大学生命科学与工程学院实验室在梁山慈竹分子层面研究上取得一定进展[5],并获得多个品系梁山慈竹的转录组数据[6-7],这为梁山慈竹EST-SSR分子标记的开发提供了坚实的基础。在EST-SSR标记开发过程中,PCR过程对后续电泳条带的读取具有直接的影响[8],为保证PCR结果的可靠性,本研究对影响梁山慈竹 SSR-PCR 结果的主要因子进行优化,以获得较好的反应体系,为后续梁山慈竹的遗传多样性、性状关联分析及分子辅助育种等研究奠定良好的基础。
1 材料与方法
1.1 仪器设备
移液枪、PCR扩增仪、琼脂糖凝胶电泳仪、垂直板电泳仪、凝胶成像仪、通风橱、离心机、数码相机等。
1.2 试验材料
野生型梁山慈竹及梁山慈竹20个栽培品系叶片,由西南科技大学生命科学与工程学院实验室提供。
1.3 DNA提取及检测
21个梁山慈竹品系的叶片基因DNA采用改良的十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)法进行提取[9],并采用1%琼脂糖凝胶电泳、紫外分光光度法分别检测提取的DNA质量、浓度;分别取各品系DNA溶液10 μL,用蒸馏水稀释至20 ng/μL后,在-20 ℃冰箱中保存,备用。
1.4 SSR-PCR体系优化
以野生型梁山慈竹叶片DNA为模板,使用SSR引物BMK.38757(表1),对影响SSR-PCR效果的Taq PCRMix用量、引物浓度、DNA模板用量采用3因素4水平正交试验进行优化,具体设计见表2,反应总体积为20 μL,不足的加双蒸水补齐。反应程序为:95 ℃预变性3 min;95 ℃变性30 s,56 ℃下退火 30 s,72 ℃延伸25 s,32个循环;72 ℃延伸 5 min;4 ℃ 保存。采用8%聚丙烯酰胺凝胶电泳2.5~3.0 h,电泳恒定电压为600 V;使用ACS染液(2%硝酸银,10%乙醇,0.5%冰醋酸)染色15~20 min,蒸馏水冲洗后,浸没于由3%氢氧化钠(NaOH)、0.1%甲醛配制成的显影液中显影约 15 min,至条带清洗;采用数码相机拍照记录。
1.5 SSR-PCR反应体系验证
以野生型梁山慈竹叶片DNA为对照(CK),以20个梁山慈竹品系叶片DNA为试验材料,以 BMK.38757、L6、R83为引物,分别在退化温度为56、55、57 ℃,其他反应程序同“1.4”节条件下对优化的 SSR-PCR反应体系稳定性及引物扩增的多态性进行验证。
2 结果与分析
2.1 梁山慈竹叶片DNA的提取与检测
由图1可见,21个梁山慈竹品系的叶片DNA电泳后均具有明亮的条带,且条带没有明显的拖尾。紫外分光光度计检测结果显示,各品系DNA在波长分别为260、280 nm处的吸光度比值均在 1.7~1.9之间,DNA浓度均在200 ng/μL以上,说明DNA降解较少,蛋白杂质污染相对较轻,提取质量较高,可满足后续试验要求。
2.2 梁山慈竹SSR-PCR体系的优化
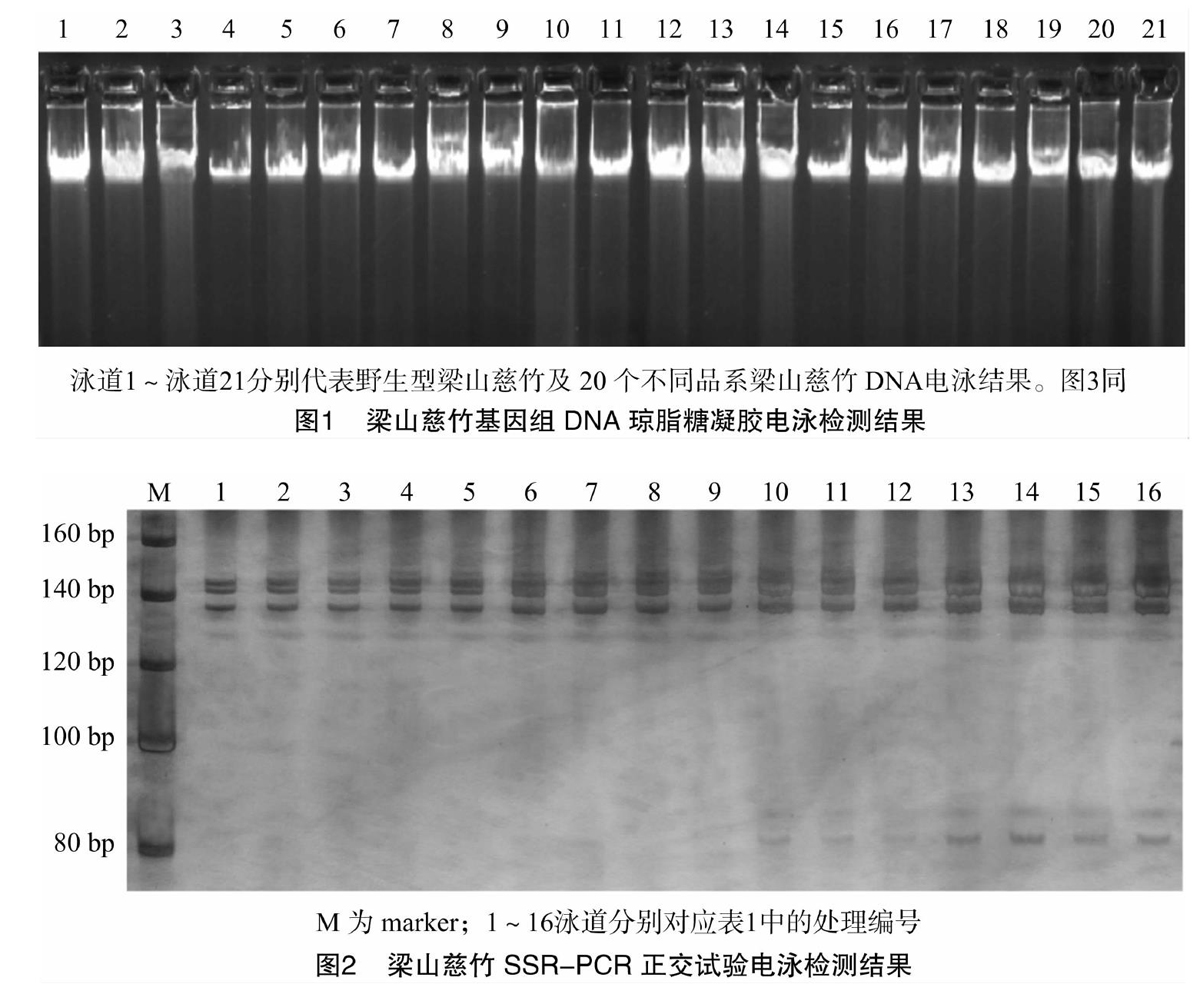
由图2可知,采用引物BMK.38757共扩增出4条条带;Taq PCRMix用量为10~12 μL(泳道9~泳道16)时,条带染色过深,且容易出现引物二聚体;在Taq PCRMix用量相同条件(泳道1~泳道4)下,引物浓度或模板DNA用量的增加可以提升PCR的扩增效果;泳道5~泳道8的条带则进一步表明,模板DNA用量的增加会使扩增条带逐渐清晰,而引物浓度对扩增结果影响相对较小。因此,优化的梁山慈竹SSR-PCR体系为2×Taq PCRMix 8 μL,模板DNA用量(20 ng/μL)2.5 μL,SSR引物(1.0×10-4 mmol/L)1 μL,无菌蒸馏水补足至20 μL。
2.3 梁山慈竹SSR-PCR优化反应体系的验证
使用SSR引物BMK.38757,对野生型梁山慈竹及20个梁山慈竹栽培品系采用优化反应体系进行PCR扩增,结果(图3)显示,共获得4个多态性位点,产物大小均在140 bp左右,条带清晰,容易分辨,且均未见引物二聚体的产生。
图4-(1)、图4-(2)分别为采用引物L6、引物R83在优化体系下对部分梁山慈竹品系的PCR扩增结果,结果表明,2个引物均可获得3个等位多态性位点,说明优化体系能够适用于多对引物,能够得到清晰、无拖尾、易于读取的条带。
3 结论与讨论
简单重复序列标记由于具有共显性、数量丰富、多态性高、开发容易且开发时间短等特点[10],自该技术诞生以来,得到广大科研工作者的青睐,目前该技术已经被广泛应用于动植物的遗传多样性分析、遗传图谱构建、目标基因定位、品种鉴定及辅助育种等研究[11-16]中。由于竹类植物以无性繁殖为主,其遗传多样性分析、分类等分子水平上的研究难度较大[17],因此,将SSR分子标记手段应用在竹类植物研究上具有重要的意义。
SSR分子标记的技术基础是PCR扩增,影响PCR扩增的因素将直接影响SSR分子标记的结果。本研究对梁山慈竹SSR-PCR的引物浓度、模板DNA浓度、Taq PCRMix等设计3因素4水平正交试验,获得的最佳反应体系为Taq PCRMix 8 μL,模板DNA(20 ng/μL)2.5 μL,SSR引物(1.0×10-4 mmol/L) 1 μL,无菌蒸馏水补足至20 μL。
采用优化的反应体系对野生型梁山慈竹及20个梁山慈竹栽培品系进行PCR扩增,部分引物获得较好的多态性位点,其中,引物BMK.38757获得4个多态性位点,引物L6、R83均可获得3个多态性位点。表达序列标签SSR(EST-SSR)标记可用于梁山慈竹不同栽培品种间的遗传分析,结合性状关联分析[18-19]能够应用于优良竹种选育与鉴别,有利于加快育种速度。
参考文献:
[1]郭小平,赵元明,刘毓侠. SSR技术及其在植物遗传育种中的应用[J]. 华北农学报,1998,13(3):73-76.
[2]Skinner D M,Beattie W G,Blattner F R,et al. The repeat sequence of a hermit crab satellite deoxyribonucleic acid is(-T-A-G-G-)n-(-A-T-C-C-)n[J]. Biochemistry,1974,13(19):3930-3937.
[3]Ali S,Müller C R,Epplen J T. DNA finger printing by oligonucleotide probes specific for simple repeats[J]. Human Genetics,1986,74(3):239-243.
[4]吴妙丹. 毛竹EST-SSR标记的开发和利用[D]. 杭州:浙江农林大学,2010.
[5]李晓瑞,胡尚连,曹 颖,等. 农杆菌介导慈竹[STBX]4CL[STBZ]基因遗传转化梁山慈竹[J]. 林业科学,2012,48(3):38-44.
[6]周振华. 梁山慈竹体细胞突变体No.29特性及其转录组分析[D]. 绵阳:西南科技大学,2015.
[7]王身昌. 梁山慈竹体细胞突变体No.30的研究[D]. 绵阳:西南科技大学,2016.
[8]杨传平,王艳敏,魏志刚. 利用正交设计优化白桦的SSR-PCR反应体系[J]. 东北林业大学学报,2006,34(6):1-3.
[9]闫庆祥,黄东益,李开绵,等. 利用改良CTAB法提取木薯基因组DNA[J]. 中国农学通报,2010,26(4):30-32.
[10]董文娟. 毛竹多拷贝SSR及其遗传多样性研究[D]. 杭州:浙江农林大学,2011.
[11]Lokko Y,Dixon A,Offei S,et al. Assessment of genetic diversity among African cassava Manihot esculenta Grantz accessions resistant to the cassava mosaic virus disease using SSR markers[J]. Genetic Resources & Crop Evolution,2006,53(7):1441-1453.
[12]荣 浩,黄 彬,周 琦,等. 61个观赏海棠品种的SSR指纹图谱构建及遗传多样性分析[J]. 南京林业大学学报(自然科学版),2018,42(3):045-050.
[13]Tsukazaki H,Yamashita K I,Yaguchi S,et al. Construction of SSR-based chromosome map in bunching onion(Allium fistulosum)[J]. Theoretical & Applied Genetics,2008,117(8):1213-1223.
[14]Riday H,Brummer E C,Campbell T A,et al. Comparisons of genetic and morphological distance with heterosis between Medicago sativa subsp.sativa and subsp.falcata[J]. Euphytica,2003,131(1):37-45.
[15]Hir Y P. 基于SSR和AFLP標记的东方百合群体遗传图谱构建及QTL定位[D]. 北京:中国农业科学院,2016.
[16]Grandon N G,Alarcon Y,Moreno M V,et al. Genetic diversity among alfalfa genotypes (Medicago sativa L.) of non-dormant cultivars using SSR markers and agronomic traits[J]. Revista de la Facultad de Ciencias Agrarias,2013,45(2):181-195.
[17]吴妙丹. 毛竹EST-SSR标记的开发和利用[D]. 杭州:浙江农林大学,2010.
[18]李昌荣. 大花序桉生长和材性遗传变异及SSR关联分析[D]. 北京:中国林业科学研究院,2017.
[19]谭文丽. 木薯SSR标记与表型的关联分析[D]. 郑州:河南农业大学,2014.
收 稿日期:2019-02-12
基金项目:四川省“十三五”重点攻关项目(编号:2016NYZ0038)。
作者简介:王丽丽(1992—),女,山东临沂人,硕士,从事植物遗传与品种改良。E-mail:1298901076@qq.com。
通信作者:胡尚连,博士,教授,从事植物生理与生物技术研究。E-mail:hashanglian@126.com。
- 游戏在小学数学课堂中的实践应用探讨
- 疫情期间幼儿主题活动线上互动初探
- 通过语篇语境扩大小学生英语词汇量的研究
- 巧妙引导,品读领会
- 大班幼儿规则意识培养策略
- 幼儿园家长助教的现状、问题及对策研究
- 小学音乐教学中德育渗透的探索与实践
- 疫情期间初中英语线上教育理念实践研究
- 浅谈多元地理读物在高中区域地理学习中的应用
- 小学互动式数学课堂的实践研究
- 师生读者优秀作品选登
- 小学语文阅读课有效教学探析
- 激之于趣,授之以“渔”
- 城乡小学生语文课外阅读指导策略研究
- 逆向思维在小学美术欣赏课中的应用研究
- 为师者,应该具备“三心”
- 浅谈小学作文教学中仿写的教学策略
- 幼小衔接阶段幼儿自主管理能力的培养
- 刍议小学低年级语文趣味识字教学
- 浅谈用分数百分数解决问题的策略
- 谈中学地理教学中生活情境的创设
- 开展校园摄影教育从学生摄影作品感悟本土文化
- 做“心”级班主任,呵护学生健康成长
- 浅谈小学一年级数学的有效教学
- 在化学教学中落实立德树人任务
- prefight
- prefilter
- prefilters
- prefinance
- pre-finance
- prefinanced
- prefinances
- prefinancial
- prefinancing
- prefinish
- prefinishes
- prefinishing
- prefix
- prefixable
- prefixally
- prefixation
- prefixed
- prefixes
- prefixing
- prefixion
- prefixions
- preflame
- preflood
- preforbidden
- preforgave
- 菜箱
- 菜篓子
- 菜篮
- 菜篮子
- 菜篮子价格
- 菜篮子工程
- 菜篮子打水——一场空
- 菜篮子经济
- 菜篮子装泥鳅
- 菜篮装泥鳅——跑的跑,溜的溜
- 菜籽
- 菜籽不打不出油
- 菜籽落到针眼里——凑巧了
- 菜羊
- 菜羮豆饭
- 菜羹
- 菜羹和肉羹
- 菜肚
- 菜肠
- 菜肴
- 菜肴、瓜果等滋味好
- 菜肴、瓜果等滋味美好
- 菜肴丰盛
- 菜肴因盐少而没有味道
- 菜肴极丰盛