袁晓晴 彭凌 陈锦红 温权 刘博婷 蔡巩林

摘要:对猪丹毒丝菌SpaA蛋白进行生物信息学分析,并对比了猪丹毒丝菌弱毒菌株和野生强毒菌株间的差异。结果显示,由于猪丹毒丝菌GC42的SpaA蛋白缺少一段含有80个氨基酸的序列,使得该菌株的蛋白质相对分子质量、氨基酸组成、二级和三级结构与强毒株的SpaA蛋白质相比均有所差异,导致这2株菌株引发机体产生的免疫原性和抗原性强弱有所不同,推测这2株菌株中,SG7菌株的免疫原性相对GC42較强;GC42菌株的抗原性相对SG7菌株的抗原性来说较弱,而猪丹毒丝菌GC42菌株的毒力相对猪丹毒丝菌SG7菌株较弱,因此呈现弱毒菌株特性;推测2株菌株的氨基酸序列均在193~206、217~231、290~309、313~327、328~376、386~457区段具有较高的形成B细胞表位的可能性。
关键词:猪丹毒丝菌;SpaA蛋白;弱毒菌株;生物信息学分析;B细胞抗原表位
中图分类号: S852.61 ?文献标志码: A ?文章编号:1002-1302(2020)17-0070-06
猪丹毒丝菌(Erysipelothrix rhusiopathiae)是一种人畜共患传染病的病原菌,人感染后表现为类丹毒症状,猪感染后表现急性或亚急性败血症,这种病原菌广泛分布在各个国家,我国也是猪丹毒流行较广泛的国家之一[1]。猪丹毒是一种自然疫源性疾病,其传染源主要包括病猪和带菌猪的分泌物、排泄物及死猪污染的饲料、饮水、土壤等[2];这不仅对世界各地畜禽养殖业的经济造成了巨大损失,而且还严重危害了人类的健康[3]。目前,已有多种灭活疫苗和弱毒疫苗用于预防猪丹毒的流行,虽然这些疫苗的应用对预防和控制猪丹毒的暴发确实起到一定的积极作用,但由于猪丹毒丝菌有较多的血清型,使得疫苗的免疫保护效果存在严重的局限性,因此研制安全高效的疫苗是目前对控制猪丹毒流行较为有效的手段[4]。
随着生物信息学的快速发展,利用生物信息学软件对所获得的生物信息数据进行分析已是常用的方法[4]。迄今为止,已有很多研究者通过生物信息学的方法对所获得的数据进行分析预测[5],本研究通过生物信息学相关软件对猪丹毒丝菌强毒、弱毒菌株的表面蛋白抗原A(surfactant proteins antigen A,SpaA)基因序列进行同源性分析及结构域对比,从而对SpaA基因指导的蛋白质一、二、三级结构及B细胞表位进行预测,对比猪丹毒丝菌弱毒菌株和野生强毒菌株之间的差异,试图对弱毒菌株减毒原因进行分析,以期为SpaA蛋白作为猪丹毒丝菌亚单位疫苗的候选抗原提供理论依据,同时也为猪丹毒杆菌SpaA蛋白功能研究提供线索[5]。
1 材料与方法
1.1 菌株
从广东地区分离得到的猪丹毒丝菌野外分离株SG7,经动物试验鉴定为强毒株。猪丹毒丝菌弱毒株GC42,从广西丽原生物股份有限公司的猪瘟、猪丹毒、猪肺疫三联活疫苗中分离得到。
1.2 SpaA基因聚合酶链式反应(PCR)扩增与测序
按照SpaA(EF688017)的基因序列及载体多克隆位点,运用Primer Premier 5.0软件来设计特异性引物的序列,在引物序列的5′端上插入2个酶切位点,分别为BamHⅠ酶切位点与EcoRⅠ酶切位点。上游引物SpaA-1:5′-CGCGGATCCATGAAAAAGAAAAAACACC-3′。下游引物SpaA-2:5′-CCGGAATCCCTATTTTAAACTTCCATCGT-3′。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火45 s,72 ℃延伸2 min,30个循环后,72 ℃延伸7 min。将PCR产物连接载体后再送至生工生物工程(上海)股份有限公司进行测序。
1.3 猪丹毒丝菌SG7和GC42的SpaA基因的理化性质分析
通过ExPASy服务器来分析猪丹毒丝菌SpaA基因的性质;通过Prot Param来分析蛋白质的氨基酸序列组成、相对分子质量、等电点等物理化学性质;通过SignalP 4.0来预测蛋白质的信号肽。
1.4 猪丹毒丝菌SG7和GC42的SpaA蛋白二级结构预测
通过ExPASy服务器上的SOPMA方案进行预测猪丹毒杆菌SpaA蛋白的二级结构。
1.5 猪丹毒丝菌SG7和GC42的SpaA基因结构域和功能预测
使用NCBI中的CDD(Conserve Domain Database)数据库对猪丹毒丝菌SG7和GC42的SpaA基因序列进行保守结构域分析。
1.6 猪丹毒丝菌SG7和GC42的SpaA蛋白三级结构预测
利用SWISS-MODEL构建猪丹毒丝菌SG7和GC42的SpaA蛋白的三级结构。
1.7 猪丹毒丝菌SG7和GC42的SpaA蛋白B细胞表位的预测
通过DNAStar软件对猪丹毒丝菌SG7和GC42的SpaA蛋白质的亲水性、柔韧性、抗原性和表面可及性等各方面的参数进行预测。
2 结果与分析
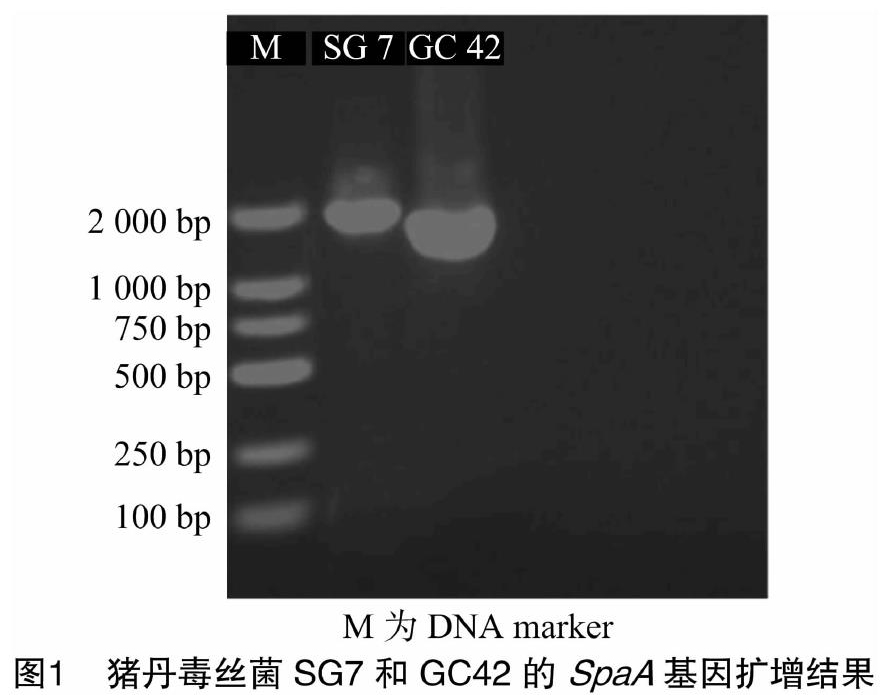
2.1 猪丹毒丝菌SpaA基因PCR扩增结果
扩增结果由图1可知,SG7菌株的SpaA基因全长为1 881 bp,GC42菌株的SpaA基因全长为1 641 bp,缺失240 bp。
2.2 猪丹毒丝菌SG7和GC42的SpaA基因序列翻译结果
SpaA基因序列翻译结果由图2可知,由于GC42菌株相比SG7菌株而言缺少一段氨基酸序列,缺少的这段氨基酸序列在猪丹毒丝菌SG7氨基酸序列的 463~543 区段。利用 ExPASy 和 SOPMA在线软件对这一段氨基酸序列进行分析,结果显示,缺失的这段氨基酸序列含有80个氨基酸,相对分子量为9 259.59,理论等电点(PI)为9.70,亲水性的平均值(GRAVY)为-0.714,即缺失的这一段氨基酸形成的蛋白质为亲水性的碱性蛋白质。同时,猪丹毒丝菌SG7的氨基酸序列与猪丹毒丝菌GC42的SpaA基因氨基酸序列还存在单个氨基酸差异,其中,在203的氨基酸位点中,猪丹毒丝菌SG7的氨基酸为甲硫氨酸,而猪丹毒丝菌GC42的氨基酸为异亮氨酸,这一变化可能导致猪丹毒丝菌GC42的SpaA蛋白质的三级结构较松散,在461位点中猪丹毒丝菌SG7的赖氨酸在猪丹毒丝菌GC42中被替换成天冬酰胺,这一替换可能会影响猪丹毒丝菌GC42的SpaA蛋白质的等电点。
2.3 理化性质分析
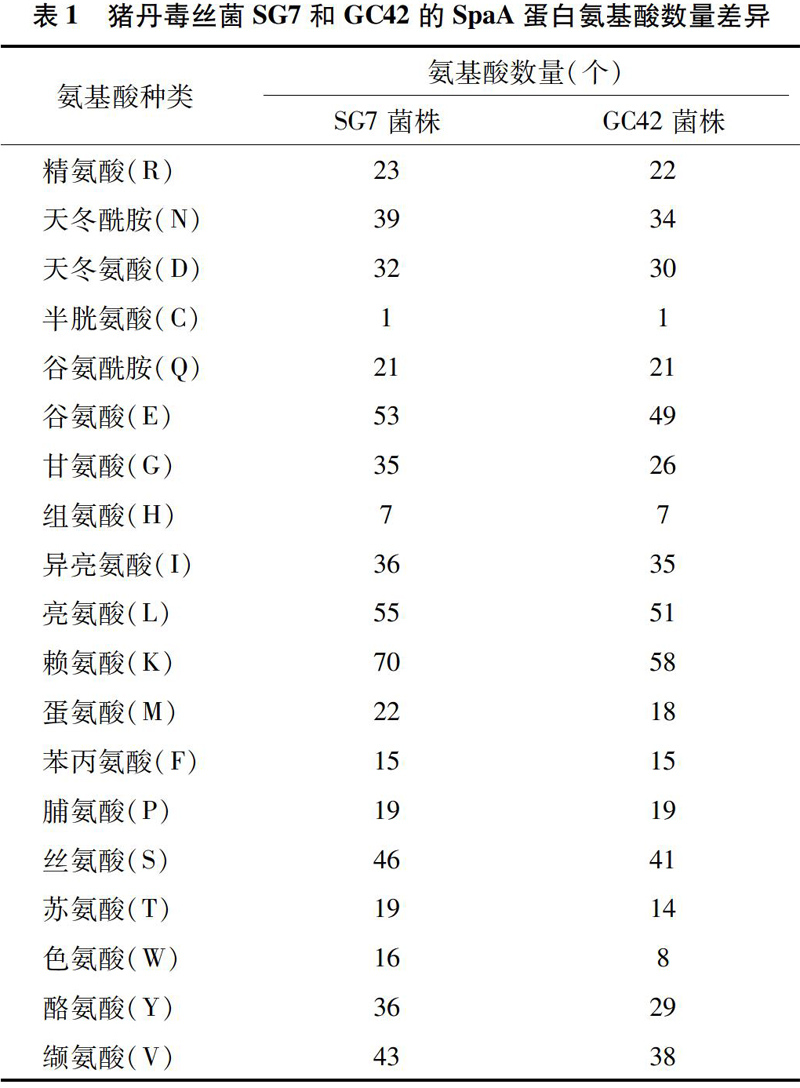
利用ExPASy(http://expasy.org/tools/protparam.html)在线软件对猪丹毒丝菌SG7和GC42的SpaA蛋白质理化性质进行预测分析可知,猪丹毒丝菌SG7的SpaA蛋白质共有626个氨基酸,蛋白质相对分子量为72 289.85,猪丹毒丝菌GC42的SpaA蛋白质共有546个氨基酸,蛋白质相对分子量为63 037.24,猪丹毒丝菌SG7和GC42的SpaA蛋白的氨基酸数量差异見表1,其中赖氨酸、酪氨酸和色氨酸均有明显差异;根据理论的等电点值分析可知,猪丹毒丝菌SG7的SpaA蛋白质理论等电点为8.82,猪丹毒丝菌GC42的SpaA蛋白质理论等电点为7.61,其中,猪丹毒丝菌SG7的SpaA蛋白质为碱性蛋白质,猪丹毒丝菌GC42的SpaA蛋白质则为中性蛋白质。
2.4 蛋白质亲疏水性分析
利用ExPASy在线软件对猪丹毒丝菌SG7和GC42的SpaA蛋白质亲水系数进行预测,结果显示,猪丹毒丝菌SG7的SpaA蛋白质亲水性的平均值为-0.568,猪丹毒丝菌GC42的SpaA蛋白质亲水性的平均值为-0.552;猪丹毒丝菌SG7和GC42的SpaA蛋白质均表现为亲水性,其中猪丹毒丝菌GC42的SpaA蛋白质亲水性较弱。
2.5 蛋白质信号肽预测
信号肽是一种位于分泌蛋白的N端并引导新合成的蛋白质向分泌通路转移的肽链,对于外泌蛋白的分泌起主导作用[5],采用ExPASy中的SignalP 4.0分析猪丹毒丝菌SG7和GC42的SpaA蛋白质的氨基酸序列信号肽的存在位置及序列,结果(图3)显示,猪丹毒丝菌SG7和GC42的SpaA蛋白质氨基酸序列上信号肽的剪切位点均位于第 28~32个氨基酸(图3-a为猪丹毒丝菌SG7的SpaA蛋白质的氨基酸序列信号肽,图3-b为猪丹毒丝菌GC42的SpaA蛋白质的氨基酸序列信号肽)。
2.6 二级结构预测
利用SOPMA在线软件对猪丹毒丝菌SG7和GC42的SpaA蛋白质的二级结构进行预测,分析结果由表2可知,各组成所占百分比表现为α螺旋>无规则卷曲>延伸链>β转角;其中α螺旋是猪丹毒丝菌GC42的SpaA蛋白氨基酸序列减少最多的结构,其次是延伸链。
2.7 结构域和功能预测
使用NCBI中CDD数据库对猪丹毒丝菌SG7和GC42的SpaA蛋白质的进行保守结构域分析,结果显示,猪丹毒丝菌SG7和GC42的SpaA蛋白质在羧基端(446~625)均存在一个重复结构域为葡聚糖结合域,预测为该保守的重复结构域属于N-乙酰基胞壁酰-L-丙氨酸酰胺酶家族蛋白, 同时,根据吾鲁木汗·那孜尔别克等通过被动免疫试验证实了猪丹毒丝菌的SpaA蛋白中主要免疫保护效应的核心区段为氨基端(88~431)[6],但猪丹毒丝菌GC42的SpaA蛋白缺少的氨基酸序列位于猪丹毒丝菌SG7的氨基酸序列区段的羧基端(463~543),因此这一缺失对蛋白氨基端所引起的免疫保护并无太大影响。
2.8 三级结构预测
利用SWISS-MODEL构建了2种蛋白质的模型,由图4可知,猪丹毒丝菌SG7的SpaA蛋白模型主要由β-折叠分布在表面,由无规则卷曲连接形成,且整体结构均较为紧密,而猪丹毒丝菌GC42的SpaA蛋白模型主要由3条α-螺旋通过无规则卷曲连接形成,排列相对松散。
2.9 B细胞表位的预测
通过DNAStar软件对猪丹毒丝菌SG7和GC42的SpaA蛋白质的亲水性、柔韧性、抗原性和表面可及性等各方面参数进行预测,由图5、图6可知,虽然B细胞抗原表位的数量及抗原表位出现的肽段可能有所不同(表3),但猪丹毒丝菌SG7和GC42的SpaA蛋白的氨基酸序列均在193~206、217~231、290~309、313~327、328~376、386~457间的这些区段在各方案所预测的参数值均高于其他区段,因此这几个区段具有较高形成B细胞表位的可能性。
3 讨论
免疫原性是指能引起免疫应答的性能,一般包括多糖和蛋白质。一种物质的免疫原性强弱受多方面的影响,包括该物质自身的性质、异种性、宿主遗传性等。具有免疫原性的物质分子量越大, 免疫原性就越强,而在所有含有大量芳香族氨基酸尤其含有酪氨酸且具有免疫原性蛋白质分子中,其免疫原性更强。本研究中,由于猪丹毒丝菌GC42的SpaA蛋白缺少一段含有80个氨基酸的序列,从而使猪丹毒丝菌GC42的SpaA蛋白质在相对分子质量和氨基酸数量组成上与猪丹毒丝菌SG7的SpaA蛋白质相比有所差异,这使2株菌株引发机体产生的免疫原性的强弱不同;根据这2株菌株的结构域分析,猪丹毒丝菌GC42的SpaA蛋白虽缺少一段氨基酸序列,但猪丹毒丝菌GC42的SpaA蛋白缺少的氨基酸序列位于猪丹毒丝菌SG7的氨基酸序列区段的羧基端(463~543),而猪丹毒丝菌的SpaA蛋白中起主要免疫保护效应的核心区段为氨基端(88~431)[6],因此这一缺失对蛋白氨基端引起的免疫保护并无太大影响。这些分析结果表明,猪丹毒丝菌SG7和GC42的SpaA蛋白质具有相同的保守结构域,即2株菌株均具有引起机体免疫应答的免疫原性;根据理化性质分析,猪丹毒丝菌SG7和GC42的SpaA蛋白氨基酸在序列数量上有所差异,其中差异较明显的氨基酸为赖氨酸、酪氨酸和色氨酸;猪丹毒丝菌SG72的SpaA蛋白质中赖氨酸、酪氨酸和色氨酸的数量明显高于猪丹毒丝菌GC42的SpaA蛋白质,猪丹毒丝菌SG7和GC42的SpaA蛋白质相对分子量的大小表现为SG7>GC42,这些分析结果均表明,猪丹毒丝菌SG72的SpaA蛋白质可能比猪丹毒丝菌GC42的SpaA蛋白质具有更强的免疫原性。
我们通常把病原菌的致病性强弱程度称为细菌的毒力,主要包括病原菌的侵袭力和病原菌产生的毒素,产生的毒素主要包括内毒素和外毒素,化学本质为多糖和蛋白质;蛋白质抗原与其在机体所诱导产生的抗体特异性结合的能力称为抗原性,一般来说,细菌毒力的强弱与抗原性的强弱呈正相关[7],蛋白质抗原在机体中抗原性的强弱受抗原分子大小、化学组成成分、抗原决定簇结构、抗原与被免疫动物亲缘关系远近等各方面的影响,抗原分子的立体结构不仅是决定抗原分子与淋巴细胞抗原受体结合、引起免疫应答功能的关键,而且决定着抗原与相应抗体结合,同时还是出现各种免疫反应的物质基础,蛋白质的立体结构又由氨基酸序列所决定,猪丹毒丝菌GC42的SpaA蛋白质由于缺失一段氨基酸序列,从而使猪丹毒丝菌GC42的SpaA蛋白质二级和三级结构相对猪丹毒丝菌SG7的SpaA蛋白质有明显差异;猪丹毒丝菌GC42的SpaA蛋白氨基酸序列相比猪丹毒丝菌SG7的SpaA蛋白氨基酸序列来说,α螺旋的数量减少最多且α螺旋含量减少,β-折叠、β-转角和无规卷曲等结构含量均呈现增加趋势,这可能使猪丹毒丝菌GC42的SpaA蛋白质构象变得更为松散和伸展,从而对蛋白质的抗原性有影响。猪丹毒丝菌SG7和GC42的SpaA蛋白质模型分析结果表明,猪丹毒丝菌GC42的SpaA蛋白质相比猪丹毒丝菌SG7的SpaA蛋白的立体结构更为松散些,这一空间结构的差异可能导致了抗原表位的掩盖[8]。其中,蛋白质中的α-螺旋含量与抗原性的强弱呈明显正相关[8];因此可以推测,猪丹毒丝菌GC42的SpaA蛋白质中α-螺旋含量的减少及猪丹毒丝菌GC42的SpaA蛋白质的立体结构可能是导致抗原表位结构松散,从而导致猪丹毒丝菌GC42的SpaA蛋白质在机体的抗原性比丹毒丝菌SG7的SpaA基因蛋白质在机体的抗原性弱,从而使猪丹毒丝菌GC42菌株在机体中呈现出毒力相对猪丹毒丝菌SG7菌株较弱的现象,表现出猪丹毒丝菌GC42的弱毒菌株特性。
蛋白质的抗原性并不是取决于整个蛋白质分子,而是取决于其与抗体分子结合的特异性化学基团,即抗原表位,因此通过对猪丹毒丝菌SG7和GC42的SpaA蛋白质的亲水性、柔韧性、抗原性和表面可及性等各方面参数进行预测,可寻找具有形成B细胞表位的较高可能性的氨基酸区段。根据分析预测,猪丹毒丝菌SG7和GC42的SpaA蛋白质的氨基酸序列均在193~206、217~231、290~309、313~327、328~376、386~457之间,这几个区段在各方案所预测的参数值均高于其他区段,极可能形成B细胞表位。这些分析可以表明,猪丹毒丝菌GC42的SpaA蛋白虽然因缺少一段氨基酸,相对猪丹毒丝菌SG7的SpaA蛋白而言,预测抗原表位稍有差异,但绝大多数的抗原表位预测均是相同的,即2个菌株抗原表位可能并未改变,这为猪丹毒丝菌基因工程亚单位疫苗打下了坚实的基础[9]。
参考文献:
[1]卢 琴,李明波,彭先文,等. 猪丹毒杆菌SpaA基因的生物信息学分析[J]. 动物医学进展,2015,36(9):23-27.
[2]曹文尧,李江伟,吕芳等. 丹毒丝菌SpaA基因免疫保护区的克隆与功能研究[J]. 中国预防兽医报,2007,29(7):496-500.
[3]吾鲁木汗·那孜尔别克,张 磊,何翠等. 猪丹毒丝菌天然SpaA和重组SpaA-N免疫保护效果的评价[J]. 微生物学报,2010,50(3):367-372.
[4]林 琳,江 斌,吴胜会,等. 猪丹毒杆菌SpaA基因的克隆与生物信息学分析[J]. 中国兽医学报,2013,33(8):1232-1236.
[5]冷非凡,罗 文,李渊利,等. 嗜铁钩端螺旋菌中铁硫簇相关蛋白的生物信息学分析[J]. 基因组学与应用生物学,2018,37(12):5296-5303.
[6]吾魯木汗·那孜尔别克,刘祝祥,李 科,等. 猪丹毒丝菌C43311株SpaA基因N端免疫保护区的克隆和表达[J]. 微生物学报,2008,48(2):207-212.
[7]张焕容. 副猪嗜血杆菌抗原性研究进展[J]. 动物医学进展,2010,31(7):91-94.
[8]朱业培,王 玮,吕青骎,等. 超高压协同温度处理对过敏原Bosd6抗原性及二级结构的影响[J]. 南京农业大学学报,2016,39(4):668-672.
[9]李伟杰,赵 耘,康 凯,等. 红斑丹毒丝菌SpaA抗原基因的克隆、序列分析及蛋白结构预测[J]. 中国兽医学报,2011,31(11):1631-1634,1639.
- 大数据时代以创新创业为导向的电子商务课程实践
- 基于以电商平台为核心的互联网金融研究
- 电子商务时代的客户服务分析
- 浅析电子商务对会计实务的影响
- 大学生小额跨境电子商务的现状分析
- 政府电子政务信息安全问题与应对策略
- 高校大数据平台的建设意义
- 江苏省电子商务企业发展的SWOT分析与研究
- 基于我国发展现状的垂直生鲜电商行业模式研究
- 基于社会需求的高职“商务英语”课程分类分层教学研究与实践
- “互联网+”时代旅游电子商务的发展趋势探析
- 关于电子商务专业教学模式的几点思考
- CNKI、万方、维普数据库的特点对比及中国数据建设现状
- 高校校园SNS公众平台的现状与发展对策研究
- 基于RFID物联网技术的智能物流系统设计
- 《电子商务实务》中微信“三创”人才培养的教学改革探索
- 跨境电商的内涵及对国际贸易的影响
- 基于单片机的LED点阵屏的研究与设计
- 我国农村电子商务的现状及发展策略
- 大学生村官在农村电商发展中的作用机制
- 重庆市应急物资储备现状分析
- 京东自营物流成本控制问题研究
- 当前我国工业品营销中存在的问题及对策
- 层次分析法在绿色物流中的应用
- 物流员考证课程的教学方法探索与实践
- revolutionization
- revolutionize
- revolutionized
- revolutionizer
- revolutionizers
- revolutionizes
- revolutionizing
- revolutions
- revolvably
- revolve
- revolve around sb/sth
- revolved
- revolvency
- revolver
- revolvers
- revolves
- revolving
- revolvingcredit
- revolving-door
- revolvingdoor
- revolving door
- revolving doors
- revolving line of credit
- revolvinglineofcredit
- revolvingloan
- 拚
- 拚不得
- 拚命
- 拚命吃河豚
- 拚娇
- 拚捐
- 拚搏
- 拚杀
- 拚死厮杀
- 拚死吃河豚
- 拚着一身剐,敢把皇帝拉下马
- 拚舍
- 招
- 招不着儿
- 招之不来
- 招之即来,挥之即去
- 招事
- 招事惹非
- 招亡纳叛
- 招亲
- 招人
- 招人不快或怀恨
- 招人到自己家里做女婿
- 招人喜爱
- 招人宴饮