宋聪 宋水山 贾振华


摘要:我国耕地土壤钾元素严重匮乏,亟须解决我国北方山区土壤缺钾的现状,寻求钾肥替代技术。从各地土壤中筛选得到1株高效解钾菌32-2,在含钾矿石的复筛培养基中发酵15 d,发酵液中可溶性钾含量达到37.77 mg/L,是对照的16.22倍,经鉴定为草木樨中华根瘤菌(Sinorhizobium meliloti)。通过盆栽试验结果表明,与对照相比,32-2对黄瓜种子、幼苗有显著的促生效果,其中发芽率提高13.33百分点,发芽势提高8.08百分点,株高、地下鲜质量、地上干质量、壮苗指数、干重根冠比、根系活力分别提高15.83%、13.95%、7.45%、5.19%、9.46%、38.52%;同时,可显著提高黄瓜产量和品质,黄瓜产量增加8.50%,可溶性固形物、可溶性糖、维生素C、可溶性蛋白含量分别提高6.82%、2.78%、43.21%、20.90%。今后32-2可用于微生物肥料的开发。
关键词:土壤解钾菌;筛选;鉴定;草木樨中华根瘤菌;黄瓜;促生效果
中图分类号: S182;S642.206 ?文献标志码: A ?文章编号:1002-1302(2020)17-0266-04
钾是植物生长所必需的三大营养元素之一,直接影响着植物的生长发育和抗逆性[1]。我国北方山区农作物生长缓慢,品质和产量均低于平原地区,这跟土壤有机质含量低、微生物数量与种类少、植物生长的营养元素缺乏等有关,其中有效钾含量低是造成植物生长缓慢的主要因素之一。实际上北方山区土壤并不缺钾,然而95%的土壤钾以矿物钾的形态存在,主要存在于钾长石和云母中[2],不能直接被农作物吸收和利用。因此,如何转化土壤中的矿物钾为有效钾,对缓解我国钾素供给的压力、提高农作物产量具有重要意义。微生物是地球矿质元素转化的原动力,采用解钾微生物作为土壤中钾素资源利用的转化因子,是解决山区土壤缺少有效钾的有效途径。
吴洪生等研究表明,在一定条件下,钾细菌制剂可分解土壤矿物中难溶性钾,使土壤速效钾含量比对照提高128.6%[3]。张红娟等试验结果表明,接种钾细菌能促进土壤中速效钾、磷含量较对照分别提高13.2%、84.5%[4]。多项研究结果表明,解钾菌对多种植物具有促进生长、改善品质的作用。其中,郭勋斌等发现解钾菌对水稻的生长发育具有促进作用[5]。吴洪生等研究指出,解钾菌还可改善花生品质,使花生增产17.93%[6]。薛智勇等研究发现,甘薯接种解钾菌可增产6.95%~10.27%[7]。那文志等田间试验结果表明,解钾菌对大豆有明显的增产效果,较对照增产16.85%,还可提高大豆根瘤的结瘤数,并在一定程度上抑制病虫害,起到防病、抗病、增产的效果[8]。虽然关于高解钾率的细菌已有报道,但其绝对解钾量还是很小的,所以分离筛选高效解钾菌株仍是现在研究的重点之一。本试验从全国不同山区采集的土样中分离筛选高效解钾菌株并进行鉴定,检测筛选到的解钾菌株对钾元素的利用效果,同时研究解钾菌对黄瓜种子、幼苗的促生效果及产量和品质的影响,为微生物肥料的开发提供理论依据和材料基础。
据资料显示,我国的钾肥生产只占世界的0.34%,而消耗量却占14.7%,虽然每年进口约600万t钾肥[9],但仍不能满足农业生产对钾肥的需要。在化学钾肥供不应求的情况下,开辟新的效果好、成本低、无污染的微生物肥料,挖掘山区土壤中的钾素资源,具有重要的研究和应用意义。
1 材料与方法
1.1 供试材料
1.1.1 供试土壤和菌株 试验用于解钾菌分离的土壤分别采集于河北、黑龙江、山西、云南等地的山区和丘陵地区,土壤样品共75个;供试菌株主要为胶质状芽孢杆菌10013,购自中国农业科学院微生物菌种保藏管理中心;黄瓜品种为津研1号,由天津农业科学研究院天津蔬菜研究所选育。
1.1.2 培养基 培养基主要有阿须贝氏培养基(0.2 g KH2PO4、0.2 g MgSO4·7H2O、0.2 g NaCl、5 g CaCO3、10 g甘露醇、0.1 g CaSO4·2H2O、18 g瓊脂、1 000 mL水,pH值6.8~7.0)、解钾菌选择培养基(5 g蔗糖、2 g Na2HPO4、0.5 g MgSO4·7H2O、0.005 g FeCl3、0.1 g CaCO3、1 g钾长石(400目)、18 g 琼脂、1 000 mL水)、解钾菌复筛培养基[10 g蔗糖、1 g Na2HPO4、0.5 g(NH4)2SO4、1 g MgSO4·7H2O、0.2 g酵母粉、0.1 g NaCl、0.1 g CaCO3、0.005 g FeCl3、5 g钾长石、1 000 mL水]。
1.1.3 主要仪器与试剂 Taq聚合酶、DNA marker、PCR产物纯化试剂盒均购自生工生物工程(上海)股份有限公司;引物合成和DNA测序由上海英骏生物技术有限公司完成,其他试剂为国产分析纯。电泳仪PCR仪购自Bio-RAD公司,紫外可见分光光度计均购自岛津企业管理(中国)有限公司。
1.1.4 供试土壤 盆栽土壤取自邢台市信都区浆水镇前南峪村山区土壤,其理化性质:有机质含量为24.13 g/kg,全氮含量为1.43 g/kg,全磷含量为0.91 g/kg,全钾含量为20.03 g/kg,速效氮含量为89.15 mg/kg,速效磷含量为47.15 mg/kg,速效钾含量为 119 mg/kg,pH值为7.3。
1.2 试验方法
1.2.1 解钾菌的分离筛选 从邢台等地采集共75份土样,取10 g土样加入到含90 mL无菌水的三角瓶中,振荡培养30 min,将土壤悬液稀释103、104、105倍,取 100 μL 土壤悬液涂布在阿须贝培养基和解钾菌选择性培养基中,30 ℃培养3~4 d,挑取圆形、透明、表面湿润黏稠的大菌落,划线纯化3次,将纯培养菌株于-80 ℃冰箱中保存备用。
1.2.2 解钾菌解钾能力的测定 采用解钾菌复筛培养基,按5%的接种量接种D600 nm值为1.5的各菌株发酵液,28 ℃、180 r/min培养15 d,于培养3、6、9、12、15 d 采用原子吸收法测定发酵液中的可溶性钾含量。
1.2.3 解钾菌32-2的鉴定 在解钾菌选择培养基进行菌株培养,48 h观察菌落形态。(1)菌株形态和生理生化鉴定。参照文献[10]对菌株进行形态观察和生理生化试验。(2)菌株16S rDNA鉴定。采用通用引物27F:(5′-AGAGTTTGATCCTGGCTC AG-3′)和1492R:(5′-GGTTACCTTGTTACGACT T-3′),用菌落PCR扩增菌株的16S rDNA选用扩增体系(25 μL):10×Taq Buffer 2.5 μL,25 mmol/L Mg2+ 2.0 μL,2.5 mmol/L dNTP 2.0 μL,25 pmol/μL 引物各 0.5 μL,Taq 0.3 μL,ddH2O 17. 2μL。反应条件:94 ℃预变性 5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸 90 s,循环30次;72 ℃终末延伸 10 min,4 ℃保温。
PCR产物经回收试剂盒纯化,送上海英骏生物技术有限公司进行测序,测序结果提交NCBI数据库中进行序列比对分析,选取同源性较高的序列,利用MEGA 5.0软件,构建菌株系统发育进化树。
1.2.4 解钾菌对黄瓜种子和幼苗的促生效果 挑选籽粒饱满的黄瓜种子,用75%乙醇表面消毒 30 s,蒸馏水洗涤3~4遍,25 ℃恒温培养箱中浸种24 h,然后置于铺有灭菌湿纱布的培养皿上,室温下催芽。待黄瓜种子整齐发芽后,播种于50孔塑料穴盘中,盘中装有经2次高压蒸汽灭菌的山区菜园土,试验分3个处理:处理1,菜园土中浇灌浓度为1×108 CFU/mL 32-2菌悬液;处理2,浇灌浓度为1×108 CFU/mL 10013菌悬液;处理3,清水对照(CK)。将解钾菌接于发酵培养基中,25 ℃、180 r/min 振荡培养48 h。离心发酵液,去除上层液体,用无菌水稀释菌体,混匀即为所需菌悬液。10 kg 菜园土加入菌悬液1 L,每盘播种50粒黄瓜种子,黄瓜幼苗置于光照培养箱内,温度为28 ℃,相对湿度为65%,光周期为12 h/12 h。第4天计算发芽势,第7天计算发芽率,待种子发芽结束后分别从各处理中选取12组发育基本一致的黄瓜幼苗,每组5株,培养3周,测量黄瓜茎粗、株高、鲜质量和干质量,并计算植株壮苗指数。
1.2.5 解钾菌对黄瓜产量及品质的影响 黄瓜幼苗移栽至口径为50 cm、高为35 cm的花盆中,每盆定植1株,盆中装有经2次高压蒸汽灭菌的山区菜园土,试验于河北省石家庄鹿泉区河村温室大棚中进行。采用1×108 CFU/mL 32-2和10013菌悬液灌根处理,用量为1 L/株,黄瓜生长期内每2周处理1次,共处理9次,对照为清水灌根。测定黄瓜的果实横径、纵径、平均单果质量和单株产量以及可溶性糖、可溶性蛋白、维生素C、可溶性固形物含量。其中,可溶性固形物含量采用手持折光仪测定;可溶性糖含量采用蒽酮比色测定;可溶性蛋白含量采用考马斯亮蓝染色法测定;维生素C含量采用2,6-二氯靛酚滴定法[11]测定。
1.3 数据统计与分析
数据采用Excel 2010进行处理,用DPS统计分析软件进行差异分析。
2 结果与分析
2.1 解钾菌的分离筛选
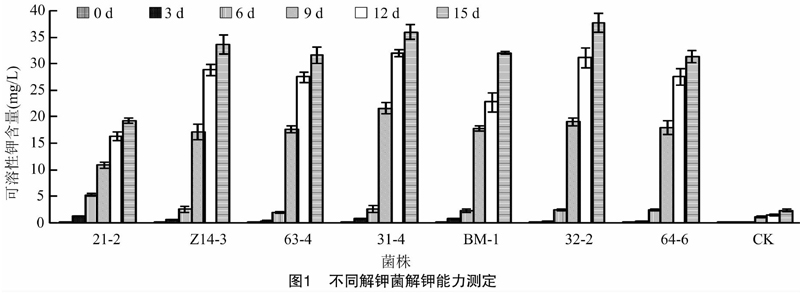
在阿须贝氏培养基和解钾选择培养基平板上进行解钾菌株的筛选,共筛选出7株解钾菌株(图1),分别命名为21-2、Z14-3、63-4、31-4、BM-1、32-2、64-6。对初筛的7株菌株进行摇瓶解钾试验,分别测定培养3、6、9、12、15 d发酵液中的可溶性钾含量,其中接种邢台油麦菜地中分离到的菌株32-2,发酵15 d时发酵液中可溶性钾含量为37.77 mg/L,是对照中可溶性钾含量的16.22倍。
2.2 解钾菌32-2的鉴定
在解钾选择培养基上进行32-2菌株培养,48 h 观察菌落形态,该菌株菌落呈圓形、边缘整齐、透明凸起、表面湿润、菌落黏稠、菌落挑起时有弹性、可拉成丝。用显微镜观察菌体发现,该菌呈革兰氏阴性,菌体椭圆形,产生椭圆形芽孢和肥大的荚膜。由表1可以看出,对菌株32-2进行16S rDNA扩增得到1条1 500 bp左右的条带,将其测序后的序列信息提交给NCBI,构建菌株系统发育进化树(图2)。可以看出,32-2与草木樨中华根瘤菌(Sinorhizobium meliloti) strain ORS1044(LMG 15285)聚于同一个支上,序列相似性达99%,结合形态观察和生理生化特性,32-2初步鉴定为草木樨中华根瘤菌(Sinorhizobium meliloti)菌株。
2.3 解钾菌32-2对黄瓜种子和幼苗的促生效果
发芽势是指种子发芽达到高峰期的发芽率,是衡量种子发芽整齐程度的指标。由表2可知,在浓度为1×108 CFU/mL的32-2和10013处理下黄瓜发芽率均显著高于对照,而32-2处理的发芽率比10013处理的高出3.93%,发芽势高出7.97%。
由表3知,32-2处理的黄瓜幼苗,其株高、地下鲜质量、地上干质量、壮苗指数、干质量根冠比、根系活力等指标均显著高于对照,且该处理的黄瓜幼苗株高、地下鲜质量、地上干质量、干重根冠比、根系活力等指标也显著高于10013处理的黄瓜幼苗。
2.4 解钾菌对黄瓜产量及品质的影响
通过测量黄瓜果实横径、纵径、单果质量、产量发现,32-2处理后果实的横径、纵径、单果质量、产量均显著高于对照,而10013处理后的果实横径、产量分别与对照无显著差异。32-2产量比对照增产8.41%,而10013处理的黄瓜产量只比对照增产0.24%(表4)。通过测量黄瓜各项品质指标发现,32-2处理后黄瓜的可溶性固形物、可溶性糖、维生素C、可溶性蛋白含量均显著高于对照,而10013处理后的黄瓜品质各项指标与对照无显著性差异(表5)。
2.5 解钾菌对土壤养分状况的影响
施用菌株32-2和10013后种植黄瓜的土壤有机质和速效钾含量均有一定程度提高。可见,微生物菌剂对改善土壤养分具有较好的效果(表6)。
3 结论与讨论
本试验发酵条件是在实验室条件下应用摇瓶试验完成的,菌株如果应用到实际生产,还应综合考虑各方面因素,在保证菌株效果的前提下,选用廉价原料和合适的培养条件,使菌剂的生产效益最大化。吴凡等在对桑树根际解钾菌进行鉴定时,发现了2株具有较强解钾能力的根瘤菌(FK11和FK8)[12]。有研究表明,接种根瘤菌对相思苗木的生长有显著的促进作用,并明显提高土壤有效钾的含量[13]。张亮等通过液体培养试验研究了8株菜豆根瘤菌对土壤钾的活化作用。由此可知,根瘤菌除具有固氮能力,某些菌株还可以活化土壤中的无效钾,从而提高土壤钾的生物有效性,达到对植物促生的效果[14]。本试验获得的高效解钾菌株 32-2 可高效分解钾矿石中的钾元素,发酵15 d时发酵液中可溶性钾含量为37.77 mg/L,是对照中可溶性钾含量的16.22倍。同时,对黄瓜有显著的促生作用,黄瓜幼苗浓度为1×108 CFU/mL的32-2处理下发芽率均显著高于对照,且處理后的黄瓜幼苗株高。地下鲜质量、地上干质量、壮苗指数、干质量根冠比、根系活力等指标均显著高于对照,同时果实的产量和品质各项指标均显著高于对照。但是,中华草木樨根瘤菌32-2的解钾机制和促生机制还有待进一步研究。
参考文献:
[1]蒋先军,黄昭贤,谢德体,等. 硅酸盐细菌代谢产物对植物生长的促进作用[J]. 西南农业大学学报,2000,22(2):116-119.
[2]别运清,胡正嘉. 硅酸盐细菌几种功能的研究[J]. 襄樊职业技术学院学报,2002(1):12-15.
[3]吴洪生,陈佳宏,刘正柱,等. 钾细菌制剂对土壤钾素的影响探讨[J]. 中国生态农业学报,2003,11(3):98-100.
[4]张红娟,张朝阳,聂 刚. 钾细菌对土壤养分活化作用的研究[J]. 杨凌职业技术学院学报,2005,4(3):4-6.
[5]郭勋斌,吴洪生,刘怀阿,等. 钾细菌制剂对水稻生长发育的影响[J]. 江西农业大学学报,2001,23(3):447-449.
[6]吴洪生,郭勋斌,刘怀阿,等. 钾细菌制剂在花生上的应用研究[J]. 广西农业生物科学,2003,22(2):119-121.
[7]薛智勇,汤江武,钱 红,等. 硅酸盐细菌在不同土壤中的解钾作用及对甘薯的增产效果[J]. 土壤肥料,1996(2):23-26.
[8]那文志,徐凤花,鲍玉杰,等. 硅酸盐菌剂的解钾作用及田间使用效果[J]. 生命科学仪器,2009,7(4):38-41.
[9]商照聪,刘 刚,包 剑. 我国钾资源开发技术进展与展望[J]. 化肥工业,2012,39(4):5-8,49.
[10]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:b349-b384.
[11]蔡庆生. 植物生理学实验[M]. 北京:中国农业大学出版社,2013.
[12]吴 凡,刘训理,张 楠,等. 桑树根际硅酸盐细菌的分离鉴定及解钾能力测定[J]. 蚕业科学,2010,36(2):323-329.
[13]张 慧,余永昌,黄宝灵,等. 接种根瘤菌对直杆型大叶相思幼苗生长及土壤营养元素含量的影响[J]. 东北林业大学学报,2005,33(5):47-48,50.
[14]张 亮,黄建国,韩玉竹,等. 菜豆根瘤菌对土壤钾的活化作用[J]. 生态学报,2012,32(19):6016-6022.
- 浅析革命与现代化之间的关系
- 邓小平和平发展观与我国国家战略转型研究
- 新形势下企业党建工作的思考
- 践行社会主义核心价值观的有效途径探索
- 以深入基层帮扶社区强化政府部门党政文化建设
- 党务工作者如何做好职工的思想政治工作
- 立足党建 不断加强思想政治工作建设
- 基层党支部书记素质提升的浅析与思考
- 建筑企业政工干部应具备的素质探讨
- 党支部在高速公路企业中的地位和作用
- 关于企业如何践行社会主义核心价值观的几点思考
- 加强基层事业单位思想政治工作的几点思考
- 当前经济形势下如何做好团员青年的思想政治工作研究
- 关于基层央行政工工作措施探讨
- 新条件下如何做好烟草企业青年职工思想政治工作
- 党员承诺切勿搞成表面文章
- 渝黔工程党建工作中存在的问题及对策
- 论金融企业思政工作与文化建设之融合探讨
- 学习马克思主义哲学的现实意义
- 弘扬长征精神 聚力中心抓备战以培养无坚不摧的打赢之基
- 当前形势下如何做好煤炭企业职工思想政治工作的研究
- 贷款视域下住房公积金的应用
- 浅谈转型经济下国企政治关联对绩效的影响
- 外币折算会计准则的国际比较
- 国际制造业转移形势下我国的应对策略
- all-of-a-heap
- all-of-a-sudden
- all of a sudden
- all-of-heap
- all-of-sudden
- all-once
- allot
- allotment
- allotments
- allotropy
- allots
- allot (sb/sth) sth
- allot sth (to sb/sth)
- allottable
- allotted
- allottee
- allotter
- allotters
- allottery
- allotting
- all-out
- all out
- all-out strike
- alloutstrike
- all over
- 流远
- 流连
- 流连光景
- 流连忘反
- 流连忘返
- 流连难舍
- 流逋
- 流逐
- 流递
- 流通
- 流通手段
- 流通时间
- 流通灌注
- 流通生
- 流通的河流
- 流通的血管
- 流通证券
- 流通费用
- 流通资本
- 流逝
- 流逝的光阴
- 流逝的岁月
- 流逝的年光
- 流逝的时光
- 流速