官宇 余伟 辜运富 张宗锦 冯文龙 杨军伟


摘要:为揭示PGPR菌剂(植物根际促生菌)对蜈蚣草修复砷污染土壤的影响机理,为植物—微生物联合修复砷污染土壤提供技术支撑,采用盆栽试验将PGPR菌剂加入受砷胁迫的蜈蚣草中进行培养,利用变性梯度凝胶电泳(denaturing gradient gel electrophoresis,简称DGGE)技术对接种PGPR菌剂的盆栽蜈蚣草根际细菌多样性进行研究,并分析根际细菌在重金属与PGPR菌剂胁迫下的群落结构特征。测定根际土壤中的砷含量、pH值、有机质含量、有效磷含量、速效钾含量,根据植株外在发育情况与内在的营养物质及对砷修复量进行比较,得出芽孢杆菌(Bacillus)添加细杆菌属(Microbacterium)细菌对蜈蚣草生长发育起到重要影响。典范对应分析(canonical correspondence analysis,简称CCA)结果显示,pH值、速效氮含量、有效磷含量是影響土壤种群结构、促进蜈蚣草吸附砷的重要因素。
关键词:PGPR菌剂;蜈蚣草;多样性;砷修复
中图分类号: X172;S182? 文献标志码: A
文章编号:1002-1302(2020)19-0275-05
收稿日期:2020-02-26
基金项目:四川省烟草研发项目计划(编号:20180027)。
作者简介:官 宇(1983—),男,重庆北碚人,硕士,农艺师,研究方向为烟草栽培。E-mail:18871453@qq.com。
通信作者:余 伟,硕士,农艺师,研究方向为烟草栽培。E-mail:1029443321@qq.com。
随着经济全球化的快速发展,经济遗留垃圾所带来的环境问题逐渐突显,如木材防腐剂带来的As-Zn 复合污染[1],农药的过度使用造成As-Pb在土壤中的富集[2]。这些残留重金属的累积不仅会对土壤本身造成污染,影响土壤中的生态环境,还会通过食物链进入到人体,威胁人类健康[3]。因此,土壤重金属修复技术逐渐受到广泛的关注,一般包括以下几种:固定、稳定化技术和土壤淋洗技术、原位电动修复技术、生物修复技术等[4-5]。相比植物修复而言,这些技术都存在着成本比较高,对环境影响程度大等缺点[6]。
近年来,关于植物修复重金属污染土壤的研究越来越多,其中超富集植物的研究是发展植物修复技术的基础。超富集植物是一种可以在体内超量累积重金属并能将其从土壤中分离的特殊植物[7]。其中,蜈蚣草是首次报道发现的一种砷的超富集植物[8],它具有耐砷特性,对砷的富集能力极强,最大含砷量是一般植株的数万倍甚至数十万倍[9],因此将蜈蚣草用于砷污染土壤的修复具有很大的研究意义。植物-微生物协同修复技术是目前最有发展潜力的一种生物修复技术,可充分发挥植物与微生物的各自优势,取长补短,提高污染土壤修复效率,杜绝二次污染,利用植物根际促生细菌(PGPR)菌剂与植物协同进行砷污染土壤修复是当前砷污染土壤生物修复的研究热点。
本试验对前期从蜈蚣草中提取出的植物根际促生细菌(PGPR)进行培养后制成菌剂,并将其接种于蜈蚣草盆栽之中,探究盆栽试验条件下,接种PGPR菌剂对砷污染土壤中蜈蚣草根际细菌群落结构和多样性的影响,并结合盆栽试验中植株生长状况、土壤理化性质、土壤砷含量的测定结果,分析PGPR菌剂对蜈蚣草生长、土壤中砷富集特性的影响,以期筛选出最佳菌剂组合,为植物-微生物联合修复砷污染土壤提供理论基础和技术依据。
1 材料与方法
1.1 盆栽试验
本试验于2016—2019年在四川农业大学温江校区进行。从网上选购33株长势几乎完全相同的蜈蚣草进行1株1盆的盆栽培养,除其中3盆不加菌剂作为空白对照(CK)之外,其他所有植株均按每3盆为1组加入不同组合的PGPR菌剂,PGPR菌剂直接接种在根围土壤中,并向每株植株土壤(包括空白对照)中加入亚砷酸钠,使砷的含量为150 mg/kg。将所有植株放入光照室内进行人工培养6个月。其中,编号T1~T10为试验组,空白对照组为T11。以芽孢杆菌(Bacillus)、农杆菌(Agrobacterium)、假单胞菌(Pseudomonas)这3类种属细菌设置菌剂组合,具体处理见表1。
1.2 蜈蚣草称质量
培养6个月后挖取盆栽蜈蚣草,每株植株以其根基处为中心,提取10 cm×10 cm正方形土壤内根系,洗净后分开保存。将根系与植株地上部在110 ℃ 下杀青0.5 h,随后调整温度至75 ℃恒温烘干,称质量,以干质量(表2)作为蜈蚣草生物量[10]。
1.3 蜈蚣草根际土总DNA的提取
采集每个重复样品中长势最好的蜈蚣草根际土壤,称取质量相当于0.5 g风干土的新鲜土样(约0.612 g),采用土壤DNA提取试剂盒[FastDNA spin kit for soil (Qbiogene公司生产)]中给定的操作步骤进行土壤总DNA的提取。
1.4 16S rRNA基因扩增
利用巢氏聚合酶链式反应(PCR)对提取出的DNA进行扩增,第1轮以27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGA-3′)为引物。PCR体系为50 μL:混合液25 μL,引物各4 μL,DNA 4 μL,双蒸水(ddH2O)13 μL。PCR程序:94 ℃ 预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸2 min,循环33次;72 ℃ 10 min[11]。第2轮以338F(GC)[5′-(CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG)CCTACGGGAGGCAGCAG-3′]和518R(5′-ATTACCGCGGCTGCTGG-3′)为引物。PCR 体系:Mix 25 μL,引物各4 μL,DNA 4 μL,加ddH2O至总体积50 μL。PCR 程序:94 ℃5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,循环30次;72 ℃ 10 min[12]。
1.5 变性梯度凝胶电泳
取第2轮PCR产物15 μL进行变性梯度凝胶电泳(DGGE)分析,设置变性剂浓度梯度为30%~60%,聚丙烯酰胺凝胶浓度为8%,在1×TAE缓冲液中于电压为120 V、温度为60 ℃下恒温电泳7 h。电泳完成后,用硝酸银进行染色[13]。DGGE图谱用数码相机进行拍照。
1.6 克隆与测序
切取“1.5”节中DGGE条带(PCR产物)用Clean-Up试剂盒进行纯化后,与pGEM-T Easy Vector载体进行连接,利用大肠杆菌(Escherichia coli) DH5α感受态细胞进行转化,转化后的细胞用氨苄青霉素抗性基因和PCR进行检测。通过蓝白斑筛选阳性克隆子并送至生工生物工程(上海)股份有限公司测序。
1.7 数据处理
利用Excle对原始数据进行基本处理和分析,SPSS 17.0进行Duncans 单因素方差分析;通过Bio-Rad公司的Quantity One 4.4进行DGGE图谱分析;基于Neighbor-joining法,用MEGA 5.0构建系统发育树;利用Shannon多样性指数(H)、丰富度(S)和均匀度(Eh)来评价群落结构多样性;采用CANOCO 4.5软件中的典型相关分析(canonical correlation analysis,简称CCA)程序对土壤细菌群落与土壤理化性质间的内在关系进行分析(P<0.05)。多样性指数计算公式为
H=-∑niNlnniN。(1)
Eh=HlnS。(2)
式中:ni为单一条带的强度;N为所有条带的总强度;S为每个泳道总的条带数。
2 结果与分析
2.1 不同PGPR菌剂组合处理下的土壤理化性质分析
从表3可以看出,土壤样品为酸性土壤,对比空白对照,各菌剂组合会降低土壤中pH值;蜈蚣草对酸性土壤有较强的耐受性,且在酸性环境下对重金属依旧有很强的吸附性[14],所以pH值的改变不影响其吸砷效果。通过对比各处理数据发现,T1试验组土壤中有机质、有效磷、速效钾、速效氮含量最高。另外,这3组处理的共同点是菌剂组合中均包括芽孢杆菌(Bacillus),可以推测芽孢杆菌(Bacillus)的添加对植株的生长环境有优化作用。
2.2 不同PGPR菌剂组合处理下的土壤群落结构分析
DGGE图谱中处在不同位置上的条带代表的细菌不同,条带数量越多,说明该样品生物多样性越丰富;菌落种属越多,其条带强度越强[15]。从图1可以看出,每个泳道中的条带在数量、强弱和位置上均存在差异性,且每个泳道有各自的优势条带,表明PGPR菌剂的添加,改变了土壤中细菌的种群结构。
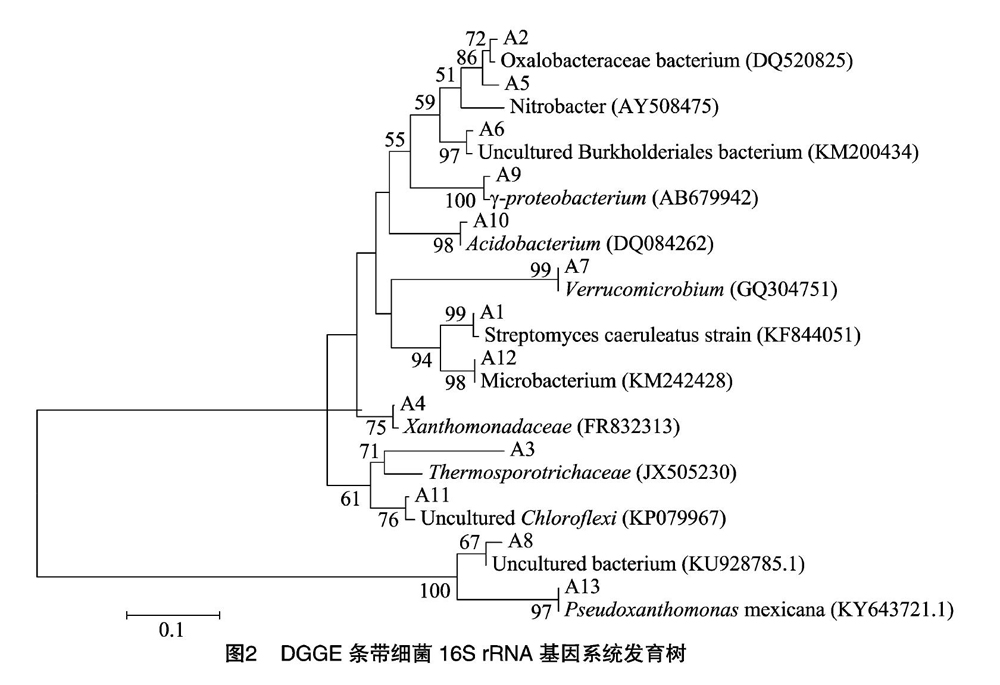
将这11个样品进行DGGE后,对电泳图谱中各样品的共有以及特异性条带进行切胶回收及克隆测序,共得到13条有效序列(A1~A13)。把测序结果与GenBank数据库内序列进行Blast比对,找出同源性最高的序列,进行系统发育树的构建,结果如图2所示。
系统发育树显示,13条回收序列所对应的分属于链霉菌属 (Streptomyces )、草酸杆菌属(Oxalobacteraceae)、Thermosporotrichaceae、黄单胞菌属(Xanthomonadaceae)、硝化杆菌(Nitrobacter)、伯克氏菌属(Burkholderiales)、疣微菌属(Verrucomicrobium)、不可培养细菌(Uncultured bacterium)、γ-变形菌(Gammar proteobacterium)、乳杆菌属(Acidobacterium)、绿色弯菌(Chloroflexi)、微杆菌属(Microbacterium)、假黄单胞菌属(Pseudoxanthomonas)。说明不同处理下的蜈蚣草根际土壤细菌具有一定的多样性和丰度。
根据图2通过Quantity one进行多样性指数计算。由表4可以看出, 不同处理的蜈蚣草样品根际土壤中微生物的丰富度、多样性、均匀度有所不同。其中,T1、T9、T10处理的多样性指数明显优势于其他处理,表明添加不同PGPR菌剂对蜈蚣草根际土壤的微生物群落结构产生的影响存在差异。
2.3 土壤理化性质与根际土壤中细菌多样性指数的相关性分析
由表5可以看出,土壤微生物群落多样性指数均与总砷含量呈极显著负相关;多样性指数、均匀度与有效磷含量呈显著正相关,说明蜈蚣草根际微生物群落结构受土壤总砷含量和有效磷含量明显影响。
2.4 土壤理化性质与土壤样品优势细菌种群结构的CCA分析
图3显示,第1排序轴解释了细菌群落变化的12.2%,第2排序軸解释了细菌群落变化的7.9%。图3中箭头连线的长度表示相应理化性质与群落结构的相关程度的大小,连线越长表示其对群落结构的影响越大。可知,pH值与2个排序轴呈负相关,而速效氮含量、速效钾含量与第1排序轴相关程度较高,且箭头线较长,说明与第1排序轴相关的土壤理化性质为速效钾含量和速效氮含量(P<0.05)。而在第2排序轴上有效磷含量箭头线较长,说明其对土壤细菌群落结构具有较大影响(P<0.05)。总体来看,本研究中土壤速效氮、速效钾、有效磷含量是影响蜈蚣草根际微生物群落结构的关键土壤理化因子。
3 讨论
3.1 不同处理下的PGPR菌剂对蜈蚣草长势和土壤理化性质的影响
刘鹏等研究指出,PGPR菌剂在农业生产上的应用效果较好[16]。本试验通过变换PGPR菌剂组合的方式,对砷胁迫下的蜈蚣草进行浇灌培养,筛选出品质、效果最好的PGPR菌剂组合,以提高蜈蚣草对于土壤中砷吸附的效应。通过综合对比发现,虽然有一部分组合菌剂对蜈蚣草并未起到促砷吸附作用,但仍然筛选出了3组与空白对照相比,对蜈蚣草长势、吸砷效果促进作用更强的菌剂,即T1、T9、T10。研究显示,不同微生物对蜈蚣草的促砷吸附效果有所不同[17]。
土壤微生物数量、种类变化对土壤中的有机质矿化速度及各种养分的状态有所影响,所以,好的微生物群落结构可以促进土壤理化指标的转化,从而提高土壤养分含量[18]。通过盆栽试验发现,与空白对照相比,对蜈蚣草有促进砷吸收作用的PGPR菌剂组合处理的土壤各项理化性质皆得到了改善。
3.2 不同PGPR菌剂组合对蜈蚣草根际中菌落结构的影响
通过分析DGGE图谱可以看到,与空白对照相比,添加不同PGPR菌剂组合的植株根际土壤细菌多样性、群落结构均存在差异性,由此表明,PGPR菌剂的添加,对土壤的种群结构产生了影响。向土壤添加或接种外源微生物会对土壤中原微生物群落结构造成直接或间接的影响,从而影响土壤所发挥的生态效应[19]。
3.3 土壤环境因子对蜈蚣草根际土壤群落的影响
土壤的环境因子会改变土壤中的微生物种群结构,典范对应分析将环境因子作为约束条件进行排序分析,从而分析出环境因子对微生物群落所产生的影响。有研究指出,根际土壤中的细菌群落数量与pH值、速效磷含量、速效氮含量呈显著相关[20]。在本研究中土壤速效氮和速效磷和速效钾是影响砷胁迫下蜈蚣草根际土壤微生物群落变异的重要因子。而在笔者所在研究团队前期研究中也发现,土壤钾含量及有效性也是影响细菌群落多样性和丰富度的重要因素[21]。可见,土壤氮磷钾等养分是影响土壤微生物群落结构的重要因素,也影响着土壤砷的有效性进而调控蜈蚣草对砷污染土壤的修复效果[22]。
4 结论
PGPR菌剂会对砷胁迫下的蜈蚣草生物量、砷富集量以及根际微生物群落结构产生明显影响,其中以添加芽孢杆菌(Bacillus)细菌的处理对蜈蚣草生长发育影响最明显。砷胁迫下,蜈蚣草根际微生物群落结构受土壤速效氮、速效钾、有效磷含量的影响。
参考文献:
[1]杨晓梅. CCA的应用现状及环境与人体健康评估[J]. 四川林业科技,2011,32(1):69-73.
[2]王海慧,郇恒福,罗 瑛,等. 土壤重金属污染及植物修复技术[J]. 中国农学通报,2009,25(11):210-214.
[3]崔岩山,陈晓晨,付 瑾. 污染土壤中铅砷的生物可给性研究进展[J]. 生态环境学报,2010,19(2):480-486.
[4]叶文玲,樊 霆,鲁洪娟,等. 蜈蚣草的植物修复作用对土壤中砷总量及形态分布的影响研究[J]. 土壤通报,2014,45(4):1003-1007.
[5]罗 磊,张淑贞,马义兵. 土壤中砷吸附机理及其影响因素研究进展[J]. 土壤,2008,40(3):351-359.
[6]李有志,罗 佳,张灿明,等. 湘潭锰矿区植物资源调查及超富集植物筛选[J]. 生态学杂志,2012,31(1):16-22.
[7]杨启良,武振中,陈金陵,等. 植物修复重金属污染土壤的研究现状及其水肥调控技术展望[J]. 生态环境学报,2015,24(6):1075-1084.
[8]谢景千,雷 梅,陈同斌,等. 蜈蚣草对污染土壤中As、Pb、Zn、Cu的原位去除效果[J]. 环境科学学报,2010,30(1):165-171.
[9]李小林,颜 森,张小平,等. Pb-Zn矿区重金属污染对微生物数量及放线菌群落结构的影响[J]. 农业环境科学学报,2011,30(3):486-475.
[10]尹元萍,张雅琼,申毓晗,等. 利用根系形态构型筛选磷高效大豆基因型[J]. 分子植物育种,2015,13(5):999-1008.
[11]邢 薇,左剑恶,林 甲,等. 20 ℃ EGSB反应器中颗粒污泥的微生物种群结构分析[J]. 环境科学,2008,29(9):2558-2563.
[12]刘 栋. 野生与养殖大鲵肠道微生物多样性分析及产酶活性研究[D]. 汉中:陕西理工学院,2016.
[13]喻国辉,牛春艳,陈远凤,等. 利用16S rDNA结合gyrA和gyrB基因对生防芽孢杆菌R31的快速鉴定[J]. 中国生物防治学报,2010,26(2):160-166.
[14]Andrade J,Corredig M. Vitamin D3 and phytosterols affect the properties of polyglycerol polyricinoleate (PGPR) and protein interfaces[J]. Food Hydrocolloids,2016,54:278-283.
[15]李榜江,王龍昌,龙明忠,等. 极端酸性条件下蜈蚣草对重金属污染环境的修复效应[J]. 水土保持学报,2013,27(5):183-187.
[16]刘 鹏,刘训理. 中国微生物肥料的研究现状及前景展望[J]. 农学学报,2013,3(3):26-31.
[17]杨 倩. 微生物提高植物修复砷污染土壤的效果和机理研究[D]. 武汉:华中农业大学,2009.
[18]周法永,卢 布,顾金刚,等. 我国微生物肥料的发展阶段及第三代产品特征探讨[J]. 中国土壤与肥料,2015(1):12-17.
[19]Sang M K,Kim D K. Plant growth-promoting rhizobacteria suppressive to Phytophthora blight affect microbial activities and communities in the rhizosphere of pepper (Capsicum annuum L.) in the field[J]. Applied Soil Ecology,2012,62:88-97.
[20]杨 超,刘国顺,邱立友,等. 不同植烟土壤微生物数量调查研究[J]. 中国烟草科学,2007,28(5):3l-36.
[21]Gu Y F,Bai? Y,Xiang Q J,et al. Degradation shaped bacterial and archaeal communities with predictable taxa and their association patterns in Zoige wetland at Tibet plateau[J]. Scientific Reports,2018,8:3884.
[22]Liao X Y,Chen T B,Xiao X Y,et al. Selecting appropriate forms of nitrogen fertilizer to enhance soil arsenic removal by Pteris Vittata:a new approach in phytoremediation[J]. International Journal of Phytoremediation,2007,9(4):269-280.
- 互联网背景下农产品电商物流发展策略研究
- 医院信息化系统的建设与应用
- 新形势下国有企业信访工作问题研究
- 浅谈工业机器人技术在自动化控制领域的实践
- 试论数字与信息化时代下的计算机技术发展应用
- 提高机械数控加工技术水平的有效方法
- 机器人视觉识别抓取物件
- 建筑工程项目管理中BIM技术的融合与应用
- 机电一体化技术在智能制造中的实践研究
- 双创背景下科技企业孵化器发展困境与对策研究
- 基层企业工会干部素质能力建设探讨
- 浅析基于客户导向的保险营销团队建设
- 林业人力资源开发中的问题与对策分析
- 移动互联网背景下企业绩效反馈的问题及对策
- 品牌吸引力、知名度、员工行为与品牌忠诚之间的关系
- 直播带货与消费心理的博弈
- 关于加快推进优先发展公共交通的建议
- 基于平衡计分卡的商业银行绩效考核
- 基于物联网的智慧物流供应链优化探究
- 中小企业经营管理营销实践人才培养研究
- 加强新就业形态从业人员劳动权益的保护
- 科技进步与人类存在方式的迭代
- 思维导图在培训中的运用
- 移动互联情境下组织领导力的塑造
- 我国社会发展中经济法的应用分析
- unrespectfully
- unrespectfulness
- unrespectfulnesses
- unrespirable
- unrespired
- unrespited
- unresplendent
- unresplendently
- unresponding
- unresponsible
- unresponsibleness
- unresponsiblenesses
- unresponsibly
- unresponsive
- unresponsively
- unresponsiveness
- unrest
- unrestfully
- unrestfulness
- unrestfulnesses
- unrestitutive
- unrestorable
- unrestrainable
- unrestrained
- unrestrainedly
- 贤民
- 贤流
- 贤淑
- 贤淑孝顺
- 贤淑文静
- 贤淑的后妃
- 贤淑的妻子
- 贤淑美丽
- 贤淑美好
- 贤淑贵妃
- 贤灵
- 贤王
- 贤甥
- 贤相
- 贤知
- 贤科
- 贤竹林
- 贤者
- 贤者云集
- 贤者仕进的机会
- 贤者出任县令
- 贤者受难
- 贤者在位,能者在职
- 贤者夭折
- 贤者容不辱。