王勇 张育铭 朱洪磊 马超 张宝俊
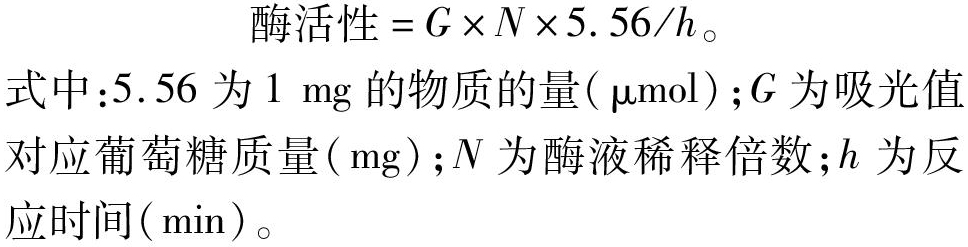


摘要:以羧甲基纤维素钠为碳源采用摇瓶富集培养、刚果红染色定性、纤维素酶活性定量分析法从常年堆积枯枝落叶的腐殖土壤中分离出纤维素降解真菌,根据菌落形态特征及多基因联合分析对其分类地位进行鉴别,并测定其降解谷子秸秆的产酶活性。筛选到具有较高产酶能力的纤维降解真菌4株,命名为MX5、DR9、DR12、TR31,4个菌株分别为篮状菌属真菌及多育曲霉、黑曲霉、巴西曲霉,其中DR12菌株分泌的滤纸酶、内切葡聚糖(CMC-Na)酶、外切葡聚糖酶活性最高,分别可达17.35、8.47、16.35 U/mL,TR31菌株分泌的β-葡萄糖苷酶活性可达24.96 U/mL。4株纤維素降解菌均可满足秸秆降解过程对纤维素酶的需求,有良好工业应用前景。
关键词:纤维素降解菌;纤维素酶;多基因联合;黑曲霉
中图分类号: S182 ?文献标志码: A ?文章编号:1002-1302(2020)23-0255-06
农作物秸秆是农业生产中产生的一类典型固态废弃物,据统计,我国每年秸秆资源产出量约为10亿 t[1]。在传统的农业生产中,仅有少量的秸秆被综合利用,大量秸秆被弃置或直接焚烧,造成了严重的资源浪费和环境污染。秸秆还田是目前解决此类问题最直接有效的手段[2-3]。秸秆还田可以有效改善土壤生态环境,培肥地力,提高作物质量[4-5]。但还田秸秆的降解过程需要多种酶的参与,其中纤维素酶对促进秸秆降解具有重要作用,自然环境中秸秆纤维素分解菌较少,且产纤维素酶的活性较低,秸秆原位还田分解速度慢,无法为当季作物提供肥料,且易给农业生产带来不利影响。因此,通过添加外源秸秆降解菌,加快秸秆的原位腐解,是促进秸秆原位降解的高效措施[6-7]。马欣雨等筛选到高效秸秆降解菌NX9、NF6,培养至第 15 d 时玉米秸秆降解率分别为53.88%、51.36%[8]。于慧娟等报道,添加菌株z-5后,小麦秸秆降解率10 d内可达47%[9]。胡海红等通过硅藻土和菌液构建的复合菌剂促进了玉米秸秆降解[10]。这些研究都证明,添加外源降解菌,可加快秸秆原位降解速度。本试验以常年堆积枯枝落叶的腐殖土壤为菌源,采用刚果红染色定性、纤维素酶活性测定定量分析筛选高效纤维素降解真菌,并通过多基因联合分析确定它们的分类地位,同时采用限制性培养基发酵并测定其产酶活性,以期为加快谷子秸秆还田与资源化利用提供有效菌剂。
1 材料与方法
1.1 供试材料
采集山西省各地常年覆盖有枯枝落叶等腐败物的土壤,并将其装入灭菌后的采样袋中,保存于山西省绿色生物农药工程技术研究中心,试验开始时间为2018年9月,试验地点为山西农业大学农学院植物保护实验室。
滤纸培养基:KH2PO4 1 g,MgSO4·7H2O 0.3 g,FeCl3 0.01 g,CaCl2·6H2O 0.1 g,NaCl 0.1 g,NaNO3 2.5 g,过60目筛的滤纸10 g,1 000 mL水,pH值7.0。
马铃薯葡萄糖琼脂(PDA)培养基:200 g马铃薯,20 g葡萄糖,15 g琼脂,蒸馏水定容至1 000 mL。
羧甲基纤维素钠培养基:NaCl 0.5 g,蛋白胨 2.0 g,K2HPO4 1.0 g,酵母膏 0.5 g,MgSO4 0.5 g,羧甲基纤维素钠15.0 g,蒸馏水1 000 mL,琼脂 15.0 g,pH值 7.0。该培养基用于刚果红染色。
发酵培养基:KH2PO4 1.0 g,NaCl 0.1 g,MgSO4·7H2O 0.3 g,NaNO3 2.5 g,FeCl3 0.01 g,CaCl2 0.1 g,谷子秸秆木质纤维素20 g,用蒸馏水定容至1 000 mL,pH值7.0。发酵培养基用于固体发酵。
真菌基因组DNA抽提试剂盒等试剂耗材购自生工生物工程(上海)股份有限公司。
1.2 纤维素降解菌的分离筛选
取采集的样品5 g用100 mL无菌水悬浮振荡 5 min,静置后取上清液1 mL加入装有9 mL无菌水的玻璃管中,稀释10倍。摇匀后,再取1 mL加入装有9 mL无菌水的玻璃管中,稀释102倍,按此方法稀释到109倍。分别吸取100 μL 10、103、105、107、109这5个稀释倍数的样液涂布于滤纸培养基上,重复3次,于25 ℃恒温培养箱中培养。根据菌落形态挑取单菌落反复纯化培养后,利用刚果红水解圈法对菌株进行初筛;并参考王琳等的纤维素酶活性测定方法[11]测定菌株发酵上清液的滤纸酶(FPA)活性,对菌株进行复筛。
1.3 纤维素降解菌产酶活力测定
按照1%的接种量将筛选到的菌株接种于发酵培养基中,于温度为30 ℃、湿度为60%的条件下,在恒温培养箱中保湿培养,从固体发酵第2天起,每隔24 h参照3,5-二硝基水杨酸法(简称DNS法)测定各菌株分泌的滤纸酶(FPA)、内切葡聚糖(CMC-Na)酶、外切葡聚糖酶(CBH)、β-葡聚糖苷酶活性等。酶活性计算公式如下:
酶活性=G×N×5.56/h。
式中:5.56为1 mg的物质的量(μmol);G为吸光值对应葡萄糖质量(mg);N为酶液稀释倍数;h为反应时间(min)。
1.4 纤维素降解菌分类地位鉴定
形态观测:将分离纯化的各菌株接种于马铃薯葡萄糖琼脂培养基平板中,在25 ℃下恒温培养 7 d后,挑取菌丝置于载玻片上,显微观察各菌株菌丝及产孢特点,对其形态特征进行观测。
分子鉴定:参照真菌基因组DNA提取试剂盒说明提取供试各菌株基因组DNA;质量检测后以各菌株基因组DNA为模板,分别以SSU、ITS、TUB(表1)为引物,建立聚合酶链式反应(PCR)扩增体系,扩增目的片段。
PCR反应体系(25 μL):上游引物(Primer1) 1 μL,下游引物(Primer2) 1 μL,ddH2O 9.5 μL,模板DNA 1 μL,PCR预混液(Mix) 12.5 μL;反应条件为94 ℃预变性5 min;94 ℃变性 30 s,(48~56 ℃)退火60 s,72 ℃延伸45 s,30个循环;最后72 ℃延伸10 min,于10 ℃保存。SSU的退火温度为 48 ℃,ITS和TUB的退火温度为56 ℃。经2%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司进行测序。
从GenBank中下载同时包含有SSU、ITS、TUB基因的其他模式菌株基因序列,参照多基因联合分析法[12-13],用MEGA 7构建所筛选菌株3个组合基因序列的Neighbor-Joining(NJ )系统发育树。
2 结果与分析
2.1 纤维素降解菌筛选结果
从分离的36株纤维素降解菌中共筛选到10株具有纤维素降解能力的真菌,菌株的刚果红染色结果如图1所示,其菌落直径与水解圈直径如表2所示。其中MX5、DR9、DR12、TR31菌株的水解圈直径与菌落直径比值平方分别为2.22、4.09、2.33、2.50,表明其具有较好的纤维素降解能力。进一步通过滤纸酶活性测定复筛选到MX5、DR9、DR12、TR31 4株高产酶纤维素降解菌,产酶活性可分别达9.48、17.22、10.26、11.13 U/mL(图2)。
2.2 纤维素降解菌产生的酶活性
图3-a表明,随培养时间的延长,MX5、DR9的CMC-Na酶活性均呈增长趋势,DR12、TR31的CMC-Na酶活性呈先增长后降低的趋势。其中DR12菌株在发酵至第8天时酶活性达到最高值,为8.47 U/mL,TR31菌株在发酵至第10天时酶活性达到最高值,为7.70 U/mL,MX5菌株在发酵至第12天时酶活性为7.33 U/mL,DR9菌株在发酵至第12天时酶活性为 7.84 U/mL,DR12菌株酶活性整体高于其他3株菌株。
图3-b表明,MX5、DR12、TR31 3株纤维素降解菌随培养时间的延长,滤纸酶活性大体呈先增长后降低趋势,在发酵至第10天时酶活性达到最高值,分别为16.65、17.35、13.60 U/mL。DR9菌株酶活性大体整体呈增长趋势,在发酵至第12天时达最高值,为10.76 U/mL,DR12菌株酶活性整体高于其他3株菌株。
图3-c表明,MX5、DR12这2株纤维素降解菌随培养时间的延长,外切葡聚糖酶活性呈先增长后降低趋势,在发酵至第10天时酶活性达到最高值,
分别为14.64、16.35 U/mL。DR9、TR31 2株菌株的外切葡聚糖酶活性呈上升趋势,在发酵至第12天时达到最高值,分别为11.27、14.99 U/mL,DR12菌株酶活性整体高于其他3株菌株。
图3-d表明,MX5、DR12、TR31 3株纤维素降解菌总体随培养时间的延长,β-葡萄糖苷酶活性呈上升趋势,在发酵至第12天时酶活性达到最高值,分别为24.38、 22.12、24.96 U/mL,DR9菌株酶活性在发酵至第 8天时达到最高值,为 16.42 U/mL,TR31菌株酶活性整体高于其他3株菌株。
2.3 纤维素降解菌形态特征
从图4、图5可以看出,MX5菌株的初生菌丝呈白色,培养3 d后有绿色粒状子囊果产生,菌落逐渐变为深绿色;显微镜下觀察发现,菌丝为无隔菌丝,分生孢子梗呈扫帚状,孢子呈圆形。DR9菌株的初始菌落呈白色,培养3 d后菌落呈黄褐色丝绒状;显微镜下观察发现,菌丝为有隔菌丝,有较长的分生孢子梗茎,顶囊呈放射状,产生少量球形孢子。DR12菌株培养2 d后菌落呈白色;培养5 d后菌落变为黑色,中心凸起,呈丝绒状,产生大量黑色孢子;显微镜下观察发现,产孢结构呈球形,分生孢子头及分生孢子均呈球形。TR31菌株培养3 d后菌落呈白色;培养7 d后菌落正面呈白色,背面呈淡黄色,菌落丝绒状平展,有放射状沟纹;显微镜下观察发现,菌丝为无隔菌丝,分生孢子梗短有横隔呈短杆状,产生少量圆形孢子。
2.4 纤维素降解菌SSU、ITS、BTU序列分析及系统发育树构建
由图6可知,MX5菌株与Talaromyces purpureogenus (KX058136.1)的同源性为100%,DR9菌株与多育曲霉 (Aspergillus proliferans AB002083.1)的同源性为92%,DR12菌株和TR31菌株分别与黑曲霉 (Aspergillus niger HM590646.1)和巴西曲霉 (Aspergillus brasiliensis FJ717695.1)的同源性为85%,结合菌株形态特征,并参考姚粟等对曲霉的描述[14]确定DR12菌株与Aspergillus niger的同源性高,TR31菌株与Aspergillus brasiliensis的同源性高。提交序列后获得4株菌株的登录号,
分别为MT106897、MT106900、MT106901、MT106902。
结合各菌株的形态特征,初步将MX5菌株鉴定为蓝状菌属真菌,将DR9菌株鉴定为多育曲霉、DR12菌株鉴定为黑曲霉菌、TR31菌株鉴定为巴西曲霉。
3 结论与讨论
农作物秸秆是农业生产中产出量巨大的可再生能源物质,秸秆在田间快速腐解是解决秸秆不合理利用造成的资源浪费和环境污染问题的高效途径之一[15-16]。廉价环保高效的微生物处理方式,一直受研究者们的关注,其中真菌分泌的纤维素酶含量高,活性较强,已有不少关于真菌降解秸秆的报道。许凤华等筛选到3株纤维素降解真菌QS2、QS6、QW9,它们均具有较高的酶活力[17];向殿军等筛选到1株纤维素降解真菌CO1,对玉米秸秆有较好降解效果[18]。本试验筛选到的MX5菌株经鉴定与蓝状菌同源性相近,目前已有关于蓝状菌株黄蓝状菌[19]及圆形蓝状菌产几丁质酶[20]的报道,而关于产纤维素酶的报道较少;王加友等筛选到的SY-403蓝状菌属菌株产滤纸酶活性为6.87 U/mL[21];Orencio 等测得Talaromyces stollii LV186菌株产羧甲基纤维素钠酶活性为12.47 U/mL,与MX5菌株产酶活性相近[22]。DR12菌株产滤纸酶、内切葡聚糖(CMC-Na)酶、外切葡聚糖酶活性均总体高于其他3株菌,最高值分别为17.35、8.47、16.35 U/mL,且产酶活性整体趋势较平稳;TR31菌株产β-葡萄糖苷酶活性最高,最高值为24.96 U/mL。4株纤维素降解菌发酵过程均表现出较高的产酶活性,且产酶高峰有间隔,可满足秸秆降解过程对纤维素酶的需求。后续研究中将以DR12菌株为中心菌株构建复合菌系,开展功能菌株相互作用的研究,开发针对谷子秸秆等地域性农作物秸秆的腐熟剂。
参考文献:
[1]石祖梁. 中国秸秆资源化利用现状及对策建议[J]. 世界环境,2018(5):16-18.
[2]王长波,平英华,刘先才,等. 我国秸秆资源“五化”利用研究进展[J]. 安徽农业科学,2018,46(7):22-26,29.
[3]石祖梁,邵宇航,王 飞,等. 我国秸秆综合利用面临形势与对策研究[J]. 中国农业资源与区划,2018,39(10):30-36.
[4]高 静,朱 捷,黄益国,等. 农作物秸秆还田研究进展[J]. 作物研究,2019,33(6):597-602.
[5]宋 平. 农作物秸秆开发利用研究进展[J]. 现代牧业,2018,2(2):26-30.
[6]刘 尧,李 力,李 俊,等. 玉米秸秆高效腐解复合菌系CSS-1的选育及组合分析[J]. 中国农业科学,2010,43(21):4437-4446.
[7]李江颂,李日强,王爱英,等. 固态发酵玉米秸秆的菌株组合和发酵条件研究[J]. 农业环境科学学报,2010,29(8):1601-1605.
[8]马欣雨,孙丽娜,卢 珊,等. 秸秆降解菌的筛选及对秸秆的降解效果[J]. 生物学杂志,2020,39(4):1198-1205.
[9]于慧娟,郭夏丽. 秸秆降解菌的筛选及其纤维素降解性能的研究[J]. 生物技术通报,2019,35(2):58-63.
[10]胡海红,孙继颖,高聚林?等. 低温高效降解玉米秸秆复合菌系发酵条件优化及腐解菌剂的研究[J]. 农业环境科学学报,2016,35(8):1602-1609.
[11]王 琳,刘国生,王林嵩,等. DNS 法测定纤维素酶活力最适条件研究[J]. 河南师范大学学报(自然科学版),1998,26(3):66-69.
[12]Lin Z Y,Wei J J,Zhang M Q,et al. Identification and characterization of a new fungal pathogen causing twisted leaf disease of sugarcane in China[J]. Plant Disease,2015,99(3):325-332.
[13]Brown J R,Douady C J,Italia M J,et al. Universal trees based on large combined proteinsequence date sets[J]. Nature Genetics,2001,28(3):281-258.
[14]姚 粟,李 輝,程 池. 23株曲霉属菌种的形态复合鉴定研究[J]. 食品发酵工业,2006,32(12):37-43.
[15]李培培,韩宝文,曹燕篆,等. 一组秸秆分解菌群的稳定性及对还田秸秆的促腐效果[J]. 中国农业大学学报,2011,16(5):45-49.
[16]欧阳家风,刘峙嵘,邹 翔. 水稻秸秆在土壤-水体系中的腐解性能[J]. 江苏农业学报,2018,34(3):546-551.
[17]许凤华,翟珊珊,刘婷婷,等. 高效纤维素降解真菌的筛选及粗酶活性[J]. 安徽农业科学,2015,43(21):7-10,17.
[18]向殿军,满莉丽,张春凤,等. 玉米秸秆纤维素降解菌的分离及发酵条件优化[J]. 安徽农业科学,2014,42(4):1159-1161.
[19]陈 述,李多川,刘开启,等. 黄蓝状菌一种几丁质酶的纯化、性质及抗菌活性[J]. 中国森林病虫,2003,22(3):6-9.
[20]杨晋伟. 小孢盘多毛孢和圆形蓝状菌次生代谢产物研究[D]. 兰州:兰州大学,2015.
[21]王加友,赵彭年,杨德玉,等. 一株纤维素分解菌的筛选、鉴定及其对玉米秸秆的降解效果[J]. 生物技术进展,2018,8(2):132-139.
[22]Orencio T M,Torres G J,Rangel L A,et al. Cellulase and xylanase production by the Mexican strain Talaromyces stollii LV186 and its application in the saccharification of pretreated corn and sorghum stover[J]. BioEnergy Research,2016,9(4):1034-1045.孙 艺,郭爱请. 石家庄市耕地人口承载力评价[J]. 江苏农业科学,2020,48(23):261-269.
- 教学质量监控体系的构建
- 服务型政府的角色确认
- 浅析新时期党政关系的完善
- 当代中国马克思主义大众化的内涵
- 如何提升国家公职人员廉政自律能力
- 炫耀性腐败内涵及其类型的探讨
- 简论“学习型政府”的建设
- “大部制”背景下的工商行政管理职能
- 国际金融危机与当代资本主义研讨会在京召开
- 我国多层次养老保险制度的思考
- 河北省沿海城市群发展构想
- 政府公共投资项目风险评价机制初探
- 以决策支持为核心的企业信息化研究
- 中部地区经济发展现状及战略对策
- 大学生创业政策研究
- 大学生就业工作法制化探析
- 北京地区大学生就业指导对策
- 高校篮球运动损伤的原因与预防
- 浅谈财务管理教学
- 南洋理工学院课程体系特色研究
- 高师地理教学的专业化发展
- 钢琴教学与心理素质培养
- 志愿服务长效机制的建构
- 高校体育教育专业理论课探究
- “洛桑学艺”中核心能力带来的启示
- nondiverging
- nondiversified
- nondivinities
- nondivinity
- survival
- survival kit
- survival kits
- survivals
- survive
- survived
- survives
- surviving
- survivor
- survivors
- susceptibility
- susceptible
- susceptibleness
- susceptiblenesses
- susceptibly
- sushi
- sushis
- suspect
- suspectable
- suspected
- suspecter
- 烦琐的仪式与法规
- 烦琐的法律
- 烦琐的礼节
- 烦琐的考订
- 烦琐细小
- 烦琐而杂乱
- 烦琐苛刻
- 烦琐苛细
- 烦琐费事的事
- 烦琐,细碎
- 烦疴
- 烦碎
- 烦礼
- 烦神
- 烦积
- 烦累
- 烦絮
- 烦纡
- 烦细
- 烦缓
- 烦缘
- 烦缛
- 烦缨
- 烦聒
- 烦肠