徐静静 冯广朋 陈建华 孙雪娜 黄晓荣


摘要:采集长江口生殖洄游期中华绒螯蟹(Eriocheirsinensis)雌蟹样品,利用16SV4区高通量测序技术研究其抱卵前后肠道菌群的多样性特征,探讨肠道菌群结构组成及与其食性特征的相关性。结果表明,雌蟹抱卵前和抱卵后的肠道样品中共检测出313个和376个OUT,特有OUT分别为112个和175个,占比分别为35.78%和46.54%。就门水平而言,柔膜菌门(Tenericutes)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)是其肠道的主要菌群;雌蟹抱卵前和抱卵后的肠道菌群具有显著性差异,变形菌门和厚壁菌门的丰度抱卵后小于抱卵前,而柔膜菌门丰度抱卵后大于抱卵前。就属水平而言,Candidatus_Bacilloplasma和Candidatus_Hepatoplasma是其肠道的主要菌群属,抱卵前占比分别为26.54%和25.81%;抱卵后占比分别为30.29%和29.05%,2个属的丰度在抱卵前后无显著差异。与抱卵前相比较而言,抱卵后雌蟹肠道菌群Chao指数和ACE指数升高,丰度增加,而辛普森指数和香农指数保持稳定,抱卵前后雌蟹肠道菌群的多样性无显著性变化。本研究揭示由于长江口中华绒螯蟹雌蟹的摄食习性和饵料组成在抱卵前后产生了变化,会对其肠道微生物多样性产生一定的影响。
关键词:中华绒螯蟹(Eriocheirsinensis);高通量测序;肠道菌群;多样性
中图分类号:S932.5+2文献标志码:A
文章编号:1002-1302(2021)01-0146-06
作者简介:徐静静(1992—),女,河南周口人,硕士研究生,主要从事水生动物生理生态学研究。E-mail:65807898@163.com。
通信作者:冯广朋,博士,研究员,主要从事渔业资源增殖养护与开发利用研究。E-mail:fgp7711@163.com。
中华绒螯蟹(Eriocheirsinensis)俗稱河蟹,广泛分布于我国长江、黄河、瓯江等流域[1],属于洄游性甲壳类动物,受精卵在河口浅海处孵化成幼体后,溯河洄游至长江中部的淡水湖泊中进行生长肥育,当亲蟹性腺发育成熟后,重新生殖洄游至长江口咸淡水处进行交配产卵,产卵场主要位于长江口崇明东滩及九段沙下游水域(121°58′~122°12′E、31°05′~31°22′N)[2]。胃含物形态学食性鉴定分析表明,洄游期的中华绒螯蟹雌蟹抱卵前后饵料来源多样,包括水生植物、藻类、甲壳类、多毛类、鱼类、软体动物、棘皮动物、卵、颗粒碎屑等,属杂食性水生动物[3]。同哺乳动物一样,水生动物肠道中亦拥有丰富多样的微生物。经过长期的适应和自然选择,肠道菌群和宿主最终可形成相互依赖的共生体系。一方面,肠道菌群依靠宿主养分赖以生存,另一方面,肠道菌群在代谢过程中产生的消化酶、维生素等产物可促进宿主机体的消化与营养吸收[4]。如朱晓燕等研究发现,鱼类肠道中嗜水气单胞菌分泌的胞外酶可促进淀粉和蛋白质的消化[5]。在养殖生产中,饲料中益生菌的添加可改善肠道菌群组成,抑制肠道内有害菌群的繁殖,提高宿主的消化机能,对机体生长具有促进作用[6-8]。
16SrRNA高通量测序技术能够深入分析肠道菌群结构和多样性,具有速度快、准确率高、灵敏性强等特点,被越来越多的学者应用于肠道菌群多样性的研究[9-11]。目前,关于鱼类和虾类肠道微生物的研究较多,而对河蟹肠道菌群多样性知之甚少,近年相关研究主要集中在河蟹肠道菌群结构[12-16],以及饲料添加物,如乳铁蛋白[17]、果胶、木聚糖[18]以及恩诺沙星和皮质醇[19]对河蟹肠道菌群的影响等。本研究以长江口抱卵前后的中华绒螯蟹雌蟹为研究对象,采用16SrRNA高通量测序技术研究其肠道菌群结构,探讨洄游期抱卵前后雌蟹肠道菌群结构的差异性,进而揭示雌蟹食性与肠道菌群的相关性,从微生物菌群的角度为蟹类的养殖生产与疾病防控提供科学依据,同时为中华绒螯蟹益生菌的开发提供参考。
1材料与方法
1.1试验材料
在长江口崇明东滩(122°4′~122°11′E、31°20′~31°25′N)采用监测船和刺网采集中华绒螯蟹,在11月采集抱卵前雌蟹,在翌年1月采集抱卵后雌蟹。选取健康活泼、大小规格相似的抱卵前雌蟹(DK组)和抱卵后雌蟹(BK组)各4只作为测定肠道微生物的样本材料。雌蟹先用无菌水冲洗,然后采用75%乙醇对其体表进行消毒,在超净工作台上解剖取出其肠道,去除肠内容物,用无菌水轻微冲洗后,立即置于-80℃冰箱冻存,用于后期提取DNA。
1.2样本总DNA的提取与PCR扩增[JP3]
采用FastDNATMSpinKitForSoil(MPBiomedicals,USA)进行样本肠道微生物DNA的提取。DNA样品浓度和质量利用1%琼脂糖凝胶电泳检测,合格后稀释至1ng/μL作为扩增模板,使用含有barcode特异性引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)来扩增16SrRNA基因的V4区域。PCR反应体系为20μL:PhusionMasterMix15μL,引物515F1μL,引物806R1μL,DNA模板1μL,蒸馏水2μL。PCR扩增程序:95℃预变性1min;95℃变性10s,50℃退火30s,72℃延伸30s,30个循坏;72℃退火5min,4℃保存。利用2%浓度的琼脂糖凝胶电泳来检测PCR产物质量。质量合格后使用QiagenGelExtractionKit纯化试剂盒进行纯化,使用QubitVersion@2.0(Invitrogen,USA)仪器进行定量。随后利用TruSeqDNAPCR-FreeSamplePreparationKit(Illumina,USA)试剂盒进行文库的构建。构建测序文库后利用IlluminaHiSeqPE250平台进行微生物16SrRNA基因V4区的高通量测序(北京诺禾致源技术有限公司)。
1.3数据处理与统计分析
利用滑动窗口法去除测序所得原始序列中的引物和标签,用Flash软件根据Overlap关系对序列进行拼接[20],对于无法拼接的Reads数据进行丢弃,利用Qiime软件对上述拼接后的序列进行过滤[21],利用Mothur软件中Uchime的方法把过滤后的数据嵌合体序列清除[22],得到最终分析的有效序列。
利用Uparse软件(Uparsev7.0.1001,http://drive5.com/uparse/)[23]进行OUT聚类,得到OUT代表序列。有效序列均一化处理后匹配OTU代表序列,获得OTU聚类结果。另外,利用Mothur软件[24]基于均一化的OUT数据得到稀释性曲线。对OTU序列利用RDPClassifier(贝叶斯算法)进行分类学分析,得到对应的物种分类信息(Silva数据库),并在各个水平上统计每个样本的群落组成。使用Muscle软件进行代表序列的系统进化关系分析,获得肠道微生物在不同分类水平上的分类。使用Qiime(Version1.7.0)和R软件进行α多样性指数和β多样性分析(主成分分析PCoA)。利用SPSS22.0进行统计学分析,当P<0.05时表示差异显著。
2结果与分析
2.1测序深度
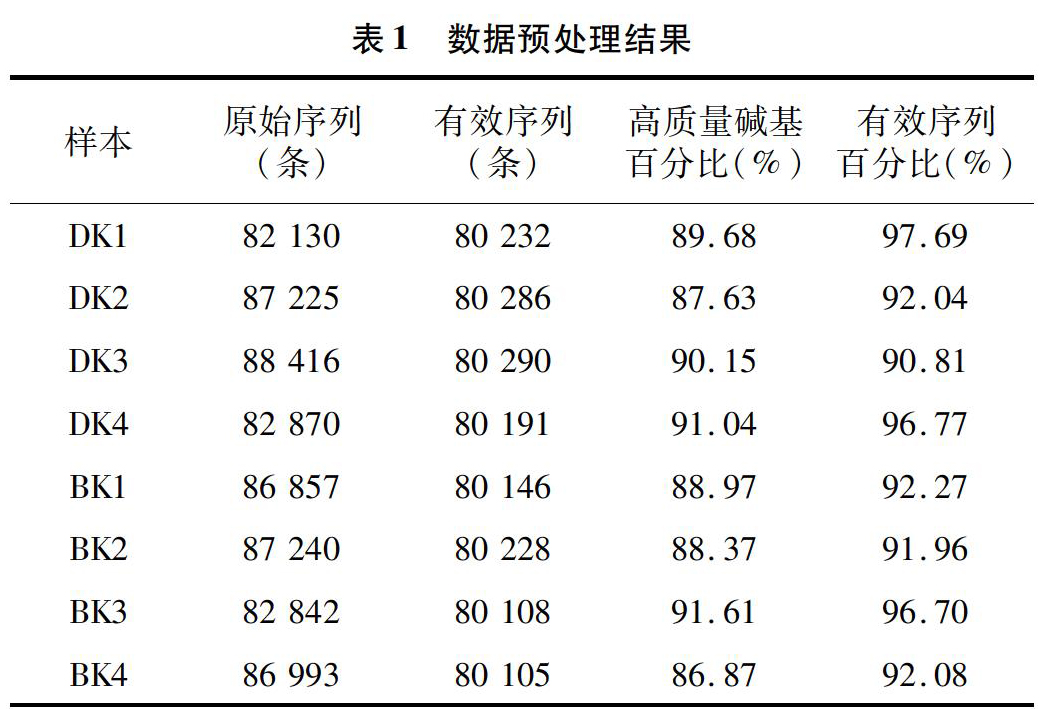
在IlluminaHiSeqPE250平台对8个样品16SrRNA基因的V4区域测序,由表1可知,经过初步过滤后,获得80105~80290条有效序列,有效序列中,碱基质量值大于20的碱基占有效序列的86%以上,有效序列数目占原始序列数目90%,样本经过均一化后获得有效序列以97%的相似性聚类到251个OUT上。由图1可知,随着序列数的增长,OUT稀释曲线趋于饱和,说明雌蟹肠道菌群16SrRNA基因的V4区数据量可反映样本肠道菌群的关系。
由表2可知,DK组和BK组的平均OTU数目分别为313个和376个,其中,2组共有OUT数量为201个,特有OUT数目分别为112个和175个,分别占DK和BK2组样品OTU总数的35.78%和46.54%。
2.2雌蟹抱卵前后肠道菌群的门分布
由图2可知,在门水平,雌蟹抱卵前后肠道核心菌群没有发生变化(除浮酶菌门外),均为柔膜菌门、变形菌门、厚壁菌门、拟杆菌门和酸杆菌门。雌蟹抱卵前和抱卵后肠道中比例最高的优势门都是柔膜菌门。以上5种优势菌门在雌蟹抱卵前肠道菌群门中占比分别为39.84%、20.12%、15.52%、8.07%和9.01%;在抱卵后肠道菌群门中占比分别为58.00%、5.12%、13.07%、9.09%和7.01%。
由图3可知,雌蟹发育成抱卵蟹的过程中,肠道菌群中柔膜菌门、变形菌门和厚壁菌门占比在雌蟹抱卵前后具有显著差异,变形菌门和厚壁菌门的丰度抱卵后小于抱卵前,而柔膜菌门丰度抱卵后大于抱卵前。
2.3雌蟹抱卵前后肠道菌群的属分布
由图4可知,雌蟹抱卵前后的主导菌属为Candidatus_Bacilloplasma和Candidatus_Hepatoplasma,这2种菌属在雌蟹抱卵前肠道菌属中占比分别为26.54%和25.81%,抱卵后的占比分别为30.29%和29.05%。Candidatus_Bacilloplasma和Candidatus_Hepatoplasma这2个属的丰度在雌蟹抱卵前后无显著性差异(P>0.05)。弧菌属(Vibrio)和气单胞菌属(Aeromonas)是雌蟹抱卵前后菌属的重要组成部分,抱卵前占比分别为6.87%和8.03%;抱卵后占比分别为5.34%和7.77%。弧菌属和气单胞菌属的丰度在雌蟹抱卵前后无显著性差异(P>0.05)。乳杆菌属(Lactobacillus)的丰度抱卵后大于抱卵前(P<0.05),棍状厌氧菌(Anaerorhabdus)的丰度抱卵后小于抱卵前(P<0.05)。除上述菌属外,雌蟹抱卵前后的肠道菌群属另有拟杆菌属、Prolixibacter、未辨認的支原体属、Dysgonomonas等。
通过对不同样本组肠道微生物的方差分析(A-MOVA)表明,雌蟹抱卵前后的肠道微生物的P=0.041,表明雌蟹抱卵前后的肠道菌群差异显著(P<0.05)。
2.4样品α和β多样性分析
由图5可知,对DK和BK这2组8个样本通过NMDS-weighted(NonmetricMultidimensionalScaling,非度量多维尺度)分析可知,雌蟹抱卵前后肠道微生物群落具有明显差异。
采用Chao指数、ACE指数、辛普森指数(Simpsonindex)和香农指数(Shannonindex)对样本菌群的丰富度和多样性进行评估,由图6可知,雌蟹在抱卵发育过程中Chao指数和ACE指数逐渐增加,表明肠道菌群丰度逐渐增加;辛普森指数和香农指数保持相对稳定,表明肠道菌群的多样性未发生显著变化。
3讨论
3.1雌蟹抱卵前后肠道菌群多样性差异
生物体内肠道微生物主要来源于周围环境、土壤和食物[25-26],并在生物体的不同生长发育阶段往往会发生变化[27]。繁殖期作为生物体的关键时期,生物体的新陈代谢强度相对较高,体内的肠道微生物亦会发生一定变化[28]。本研究结果表明,抱卵后雌蟹肠道微生物多样性大于抱卵前(P<0.05),与暗黑鳃金龟(Holotrichiaparallela)性腺发育期肠道微生物多样性逐渐增加的结果类似[29],与胡亚强等对不同生长阶段团水虱(Sphearoma)肠道微生物的研究结论[30]一致。目前,关于不同发育阶段生物体肠道微生物的变动机制仍不清楚,推测与其性激素的分泌有一定关系[31-32]。
摄食亦是影响肠道群落结构的重要因素之一[33-34],Munro等发现,鱼类摄取的活饵料是其肠道菌群的主要来源[35];郝耀彤等认为食物的改变会对草鱼肠道微生物菌群产生快速而显著的影响[36]。另有研究表明,雌蟹动物性饵料占比抱卵前大于抱卵后,而藻类和水生植物占比抱卵前小于抱卵后[3],推测本研究中抱卵前后雌蟹肠道微生物具有差异,亦与其摄食不同的饵料有关。Ley等研究发现,陆生动物肠道菌群多样性与食性有关,从肉食性、杂食性到草食性表现出逐渐增加的趋势[37]。而Mrazek等研究发现蟑螂(Nauphoetacinereaoliv)的肠道菌群多样性大于黄蜂(Vespulavulgaris)和蜜蜂(Apismellifera),认为昆虫肠道菌群多样性从草食性到杂食性逐渐增加[39]。[JP3]本研究结果与陆生动物研究结果类似,但与昆虫的研究结果相反,这可能是因为摄食对肠道菌群的影响具有一定的物种特异性,[JP3]另外不同的研究取样部位也可能对菌群组成产生一定影响。
3.2雌蟹抱卵前后肠道菌门差异性
在雌蟹肠道菌群的类别分析中发现,柔膜菌门、变形菌门、厚壁菌门和拟杆菌门为雌蟹肠道中的核心菌群,其中,柔膜菌门是肠道中的第一优势菌门,这一结果与金贝等对阳澄湖河蟹肠道菌群结构的研究[16]类似,表明柔膜菌门在其肠道中具有重要作用。柔膜菌门在肠道菌群中的占比抱卵后显著大于抱卵前,抱卵后占比较高的原因可能与柔膜菌门是维持生物体胚胎健康生长发育的微生物有关[39]。除柔膜菌门外,变形菌门和厚壁菌门是雌蟹抱卵前的优势菌门;厚壁菌门和拟杆菌门是抱卵后的优势菌门,这表明雌蟹抱卵前后的肠道菌群存在一定差异,这与变形菌门和拟杆菌门在雌蟹肠道中发挥的不同作用有关。
本研究中,雌蟹抱卵前后浮霉菌门丰度也存在一定差异,抱卵后显著大于抱卵前。研究表明,浮霉菌门多存在于厌氧环境下,并且包含多种厌氧氨氧化细菌,底泥中相对含量较高[40]。雌蟹抱卵后浮霉菌门含量较高的原因可能与抱卵后食性有关,雌蟹抱卵后行动能力弱,摄食种类受限,因此摄食比较多的颗粒碎屑和底泥,导致浮霉菌门在其肠道中比例增加。
3.3雌蟹抱卵前后肠道菌属差异性
就属水平而言,Candidatus_Bacilloplasma和Candidatus_Hepatoplasma在抱卵前后的雌蟹肠道菌群中均占较大比例,其中,Candidatus_Hepatoplasma被认为是中华绒螯蟹雌蟹和雄蟹肠道中共有的优势菌[16],揭示该菌群在中华绒螯蟹肠道内发挥重要作用,而Candidatus_Bacilloplasma则可能是雌蟹肠道中的一种潜在优势菌。
棍状厌氧细菌是一种肠杆菌,通常不会分解糖,多存在于肉食性生物肠道内[41];乳杆菌(Lactobacillus)在食草动物肠道内存在较多[42]。雌蟹肠道菌群中棍状厌氧菌的占比抱卵前大于抱卵后(P<0.05),而乳杆菌占比抱卵前小于抱卵后(P<0.05),可能是由于雌蟹抱卵后行动力减弱,植物性饵料比重升高造成的。另外,气单胞菌属在雌蟹抱卵前后的肠道中广泛存在,但由于其抗菌能力的强弱会根据宿主类型的不同而变化,因此气单胞菌属在中华绒螯蟹抗病性中是否如同在草鱼中一样发挥积极作用[43],仍有待于进一步研究。
4小结
长江口中华绒螯蟹雌蟹肠道菌群多样性丰富,柔膜菌门、变形菌门和厚壁菌门是其肠道的主要菌群,在雌蟹的生殖洄游期略有波动。结合中华绒螯蟹雌蟹抱卵前后食性分析结果表明,由于抱卵前后中华绒螯蟹雌蟹的摄食习性和饵料组成不同,会对其肠道微生物多样性产生一定影响,但并非唯一影响因素。目前来看,菌群在雌蟹肠道中发挥的作用不是十分明确,还需深入研究。
参考文献:
[1]DittelAI,EpifanioCE.InvasionbiologyoftheChinesemittencrabEriochiersinensis:abriefreview[J].JournalofExperimentalMarineBiologyandEcology,2009,374(2):79-92.
[2]蔣金鹏.长江口中华绒螯蟹产卵场分布及与重要环境因子的相关性[D].上海:上海海洋大学,2014.
[3]徐静静,耿智,冯广朋,等.长江口中华绒螯蟹雌蟹的食性和摄食强度[J].海洋渔业,2019,41(4):397-407.
[4]BairagiA,GhoshKS,KumarS,etal.Enzymeproducingbacterialfloraisolatedfromfishdigestivetracts[J].AquacultureInternational,2002,10(2):109-121.
[5]朱晓燕,汤伏生.健康家鱼肠道细菌中的嗜水气单胞菌及其胞外酶分布[J].湖北农学院学报,1994(1):35-39.
[6]潘康成,何明清,刘克琳.微生物添加剂对鲤鱼生长和消化酶活性的影响研究[J].饲料工业,1997(10):42-43.
[7]沈涛,邓斌,陈南南,等.饲料中添加复合芽孢杆菌对草鱼消化道酶活性及肠道菌群的影响[J].淡水渔业,2012,42(1):41-45.
[8]夏耘,余德光,谢骏,等.养殖水体添加嗜酸小球菌对鳜发育过程肠道微生物构成的影响[J].淡水渔业,2016,46(4):71-76.
[9]刘刚,宁宇,夏晓飞,等.高通量测序技术在野生动物食性分析中的应用[J].生态学报,2018,38(9):3347-3356.
[10]王贤丰,赵艳飞,宋志飞,等.应用高通量测序技术分析拟穴青蟹肠道及其养殖环境菌群结构[J].中国水产科学,2017,24(6):1245-1253.
[11]苏月华,陈少威,吴程,等.基于高通量测序技术研究白甲鱼肠道微生物群落组成[J].福建师范大学学报(自然科学版),2018,34(6):63-71.
[12]ChenX,DiPP,WangHM,etal.BacterialcommunityassociatedwiththeintestinaltractofChinesemittencrab(Eriocheirsinensis)farmedinLakeTai,China[J].PLoSOne,2015,10(4):e0123990.
[13]LiK,GuanW,WeiG,etal.PhylogeneticanalysisofintestinalbacteriaintheChinesemittencrab(Eriocheirsinensis)[J].JournalofAppliedMicrobiology,2007,103(3):675-682.
[14]狄盼盼.太湖养殖中华绒螯蟹肠道菌群多样性研究[D].上海:上海海洋大学,2013.
[15]陈小兵.中华绒螯蟹肠道核心菌群初探[D].上海:上海海洋大学,2015.
[16]金贝.阳澄西湖中华绒螯蟹肠道菌群结构的研究[D].南京:南京农业大学,2016.
[17]王玥.乳铁蛋白对中华绒螯蟹(Eriocheirsinensis)免疫功能及肠道菌群的影响[D].苏州:苏州大学,2011.
[18]吴韬,张振龙,蔡春芳,等.果胶和木聚糖对中华绒螯蟹肠道菌群结构的影响[J].基因组学与应用生物学,2015,34(4):745-753.
[19]郭明凯.恩诺沙星和皮质醇对中华绒螯蟹(Eriocheirsinensis)免疫功能及肠道菌群的影响[D].苏州:苏州大学,2012.
[20]MagocT,SalzbergSL.Flash:fastlengthadjustmentofshortreadstoimprovegenomeassemblies[J].Bioinformatics,2011,27(21):2957-2963.
[21]CaporasoJG,KuczynskiJ,StombaughJ,etal.QIIMEallowsanalysisofhigh-throughputcommunitysequencingdata[J].NatureMethods,2010,7(5):335-336.
[22]EdgarRC,HaasBJ,ClementeJC,etal.UCHIMEimprovessensitivityandspeedofchimeradetection[J].Bioinformatics,2011,27(16):2194-2200.
[23]EdgarRC.UPARSE:highlyaccurateOTUsequencesfrommicrobialampliconreads[J].NatureMethods,2013,10(10):996-998.
[24]SchlosspD,WestcottSL,RyabinT,etal.Introducingmothur:opensource,platformindependent,communitysupportedsoftwarefordescribingandcomparingmicrobialcommunities[J].Applied&EnvironmentalMicrobiology,2009,39(6):821-831.
[25]WardNL,StevenB,PennK,etal.CharacterizationoftheintestinalmicrobiotaoftwoAntarcticnotothenioidfishspecies[J].Extremophiles,2009,13(4):679-685.
[26]LiXM,ZhuYJ,YanQY,etal.Dotheintestinalmicrobiotasdifferbetweenpaddlefish(Polyodonspathala)andbigheadcarp(Aristichthysnobilis)rearedinthesamepond?[J].JournalofAppliedMicrobiology,2014,117(5):1245-1252.
[27]StephensWZ,BurnsAR,StagamanK,etal.Thecompositionofthezebrafishintestinalmicrobialcommunityvariesacrossdevelopment[J].TheISMEJournal,2016,10(3):644-654.
[28]LiaoC,YuD,ChenY,etal.ReproductivebehaviouroffemalerosybitterlingRhodeusocellatusinresponsetoafemale-biasedoperationalsexratio[J].Behaviour,2014,151(6):755-768.
[29]圣平.暗黑鰓金龟不同发育阶段肠道微生物及糖苷水解酶多样性研究[D].武汉:华中农业大学,2014.
[30]胡亚强,丁敬敬,黄勃,等.团水虱不同生长阶段肠道微生物多样性分析[J].基因组学与应用生物学,2016,35(2):406-413.
[31]MueggeBD,KuczynskiJ,KnightsD,etal.Dietdrivesconvergenceingutmicrobiomefunctionsacrossmammalianphylogenyandwithinhumans[J].Science,2011,332(632):970-974.
[32]FreireAC,BasitAW,ChoudharyR,etal.Doessexmatter?Theinfluenceofgenderongastrointestinalphysiologyanddrugdelivery[J].[JP3]InternationalJournalofPharmaceutics,2011,415(1/2):15-28.
[33]YunJH,RohSW,WhonTW,etal.Insectgutbacterialdiversitydeterminedbyenvironmentalhabitat,diet,developmentalstage,andphylogenyofhost[J].AppliedandEnvironmentalMicrobiology,2014,80(17):5254-5264.
[34]deFilippoC,CavalieriD,diPaolaM,etal.ImpactofdietinshapinggutmicrobiotarevealedbyacomparativestudyinchildrenfromEuropeandruralAfrica[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2010,107(33):14691-14696.
[35]MunroD,BarbourP.Comparisonofthegutbacterialfloraofstartfeedinglarvalturbotrearedunderdifferentconditions[J].JournalofAppliedMicrobiology,2010,77(5):560-566.
[36]郝耀彤,吳山功,王桂堂,等.草鱼肠道微生物对食物改变适应性变化的研究[J].淡水渔业,2015,45(3):46-51,101.
[37]LeyRE,HamadyM,LozuponeC,etal.Evolutionofmammalsandtheirgutmicrobes[J].Science,2008,320(5883):1647-1651.
[38]MrázekJ,StrosováL,FliegerováK,etal.Diversityofinsectintestinalmicroflora[J].FoliaMicrobiologica,2008,53(3):229-233.
[39]MorG,JyK.Trophoblast-microbiomeinteraction:anewparadigmonimmuneregulation[J].AmericanJournalofObstetricsandGynecology,2015,213(4):131-137.
[40]WoebkenD,LamP,KuypersMM,etal.AmicrodiversitystudyofanammoxbacteriarevealsanovelCandidatusScalinduaphylotypeinMarineOxygenminimumzones[J].EnvironmentalMicrobiology,2008,10(11):3106-3119.
[41]蔡丽萍,徐海圣,何琳,等.PCR-DGGE技术分析不同地区野生锯缘青蟹肠道菌群多样性[J].浙江农业学报,2011,23(2):278-282.
[42]张涵,周涛,王岩.综合养殖池塘中三角帆蚌和鱼类肠道细菌的组成[J].水生生物学报,2013,37(5):824-835.
[43]JiangY,XieC,YangG,etal.Cellulase-producingbacteriaofAeromonasaredominantandindigenousinthegutofCtenopharyngodonidellus(Valenciennes)[J].AquacultureResearch,2011,42(4):499-505.
- 平衡积分卡在高职院校内部控制中的应用研究
- 浅析教育事业单位内部审计存在的问题及发展对策
- 基层医疗机构预算管理中存在的问题及改进措施
- 事业单位会计制度改革对会计工作的实际影响
- 企业纳税筹划的常见误区及改进
- 浅谈勘察设计企业的项目管理与会计核算
- 对房地产企业土地增值税清算中的主要问题的研究
- 基层水利单位加强财务管理路径分析
- EVA指标在经营类事业单位中的应用
- 大数据背景下会计师事务所如何做好审计工作
- 国际会计准则的实施对收入确认的影响
- 我国小微企业所得税税收筹划研究
- 垃圾处理PPP模式金融支持研究
- 探究财政税收对市场经济发展的影响
- 上市公司收购中的商誉减值风险与应对
- 小额信贷公司资产证券化发展及前景
- 基于Heston模型的期权定价与波动率建模
- 事业单位后勤社会化管理模式的构建分析
- 浅议中小企业财务内控管理制度的建立与完善
- 公立医院绩效分配制度存在的问题及对策研究
- 专科医院现金流量管理的问题与对策
- 浅析黄金矿山企业成本管理现状及完善建议
- 行政事业单位固定资产管理问题研究
- 经济管理专业“翻转课堂”教学模式应用分析
- 经济师人力资源管理的发展现状及对策
- recalibrates
- recalibrating
- recalibration
- recalibrations
- recall
- recallabilities
- recallability
- recallable
- recalled
- recaller
- recallers
- recalling
- recalls
- recampaign
- recampaigned
- recampaigning
- recampaigns
- recancel
- recanceled
- re-canceling
- recanceling
- recancellation
- recancellations
- recancelled
- recancelling
- 恳望
- 恳款
- 恳求
- 恳求允许
- 恳直
- 恳祈
- 恳祷
- 恳至
- 恳血
- 恳言
- 恳让
- 恳诚
- 恳请
- 恳谈
- 恳谈会
- 恳谢
- 恳辞
- 恳迫
- 恶
- 恶
- 恶不去善
- 恶不可积,过不可长
- 恶不可积,过不可长。
- 恶业
- 恶乃