彭家丽 赵虎 李智佳 彭梦醒 刘永华


摘要 研究灰霉病菌接种后番茄叶片中蔗糖转化酶介导的糖分代谢的变化规律及其与发病程度之间的相关性,初步阐明蔗糖转化酶在调控番茄-灰霉病菌互作中的重要作用。通过系统测定灰霉病菌接种后不同时期(0、12、24和48 h)番茄叶片中蔗糖转化酶活性、淀粉和可溶性糖含量、细胞死亡程度和H2O2积累的动态变化,结果发现,灰霉病菌接种导致番茄叶片细胞壁转化酶(CWIN)、细胞质转化酶(CIN)和液泡转化酶(VIN)活性显著上升,其中CWIN活性最先上升且上升幅度最大,其次为CIN,最后为VIN;同时,CWIN和CIN活性在接种早期(12和24 h)上升幅度较小,而在接种后期(48 h)上升幅度较大;霉病菌接种导致番茄叶片中淀粉含量和己糖/蔗糖显著降低,但对蔗糖、葡萄和果糖含量没有显著影响;灰霉病菌接种导致番茄叶片在接种早期(24 h)发生显著的细胞死亡和H2O2积累现象。总之,灰霉病菌接种导致3种转化酶活性顯著上升,但由于其活性在接种早期上升幅度较小,其分解蔗糖产生的己糖(葡萄糖和果糖)不能满足植物防御反应的需要而出现己糖/蔗糖下降,这导致植物不能通过糖信号途径及时启动防御反应来有效清除H2O2并防止细胞死亡的发生,最终导致灰霉病的发生。
关键词 灰霉病;细胞壁转化酶;细胞质转化酶;液泡转化酶;己糖/蔗糖
中图分类号 S641.2文献标识码 A文章编号 0517-6611(2020)11-0156-05
Abstract To elucidate important roles of invertase in regulating tomatoB. cinerea interaction, the changes of invertasemediated sugar metabolism in tomato leaves after Botrytis cinerea inoculation and their correlation with the progress of grey mould incidence were studied. The dynamics of invertase activities, starch and soluble sugar content, cell death degree and H2O2 accumulation in tomato leaves at different timepoints (0, 12, 24 and 48 h) after B. cinerea inoculation were systematically investigated. It was found that cell wall invertase (CWIN), cytoplasmic invertase (CIN) and vacuolar invertase (VIN) of tomato leaves were significantly increased after B. cinerea inoculation;among three kinds of INVs, CWIN activity was induced earliest and most dramatically, followed by CIN and VIN. Furthermore, induction of CWIN and CIN activity was moderate at the early stage of inoculation (12 and 24 h), but was dramatic at the late stage of inoculation (48 h). Starch content and hexose/sucrose in tomato leaves was significantly decreased after B. cinerea inoculation, but the content of sucrose, glucose and fructose was not significantly affected. In addition, B. cinerea inoculation resulted in significant cell death and H2O2 accumulation in tomato leaves at the early stage of inoculation (24 h). Collectively, B. cinerea inoculation significantly induced the activities of three kinds of INVs. However, because the induction of INV activities was moderate at the early stage of inoculation, hexose derived from INVmediated sucrose degradation could not meet the need of plant defense response for hexose, which led to reduced hexose/sucrose. Thus, tomato plants fail to activate its defense response to effectively scavenge H2O2 and therefore prevent the incidence of H2O2induced cell death.
Key words Botrytis cinerea;Cell wall invertase;Cytoplasmic invertase;Vacuolar invertase;Hexose/sucrose
番茄(Solanum lycopersicm)是我国乃至世界上重要的蔬菜作物之一。据联合国粮农组织统计,2017年世界番茄总产量高达1.82亿t。番茄灰霉病(Botrytis cinerea)在世界各番茄产区均有发生,是一种发生普遍且危害较重的真菌病害[1-3]。发病时,一般造成番茄产量损失20%~40%,严重时高达60%以上[4-6]。然而长期大量使用化学试剂不可避免地导致灰霉病原菌逐渐产生抗药性,导致一些常规药剂失去作用,而且还会严重影响人体健康和生态环境[7-9]。通过研究番茄与灰霉病菌互作的生理生化机制,有助于选育抗灰霉病品种,从而克服上述化学防治的缺点。
蔗糖是高等植物叶片光合产物向库器官运输的主要形态,蔗糖分解代谢在植物对病原菌的防卫反应中发挥着重要作用。一方面,可以为植物防卫反应提供碳骨架和能量。如细胞壁加厚,植物抗毒素的合成以及抗病相关蛋白的积累等防卫反应都需要大量的糖分供应[10]。另一方面,蔗糖分解产生的葡萄糖和果糖也可为病菌的生长发育提供能量和碳骨架[11]。植物体内参与蔗糖分解的有蔗糖合成酶(sucrose synthase,Sus)和蔗糖转化酶(invertase,INV);Sus调控的蔗糖分解为可逆反应,既可以催化蔗糖合成又可以催化蔗糖分解,但通常认为Sus在植物体内主要起分解蔗糖作用[12-13]。INV则不可逆地将蔗糖(sucrose,Suc)水解为葡萄糖(glucose,Glc)和果糖(fructose,Fru)。INV根据其亚细胞定位不同,可以进一步细分为细胞壁转化酶(cell wall invertase,CWIN)、液泡转化酶(vacuolar invertase,VIN)和细胞质转化酶(cytoplasmic invertase,CIN)[14]。
目前对蔗糖分解代谢在植物抗病性方面的研究主要集中在CWIN。研究表明,CWIN在植物抗病性中发挥着积极作用。如超表达CWIN基因的水稻对细菌性病菌Xanthomonas oryzae pv.Oryzae和真菌性病菌Magnaporthe oryzae抗性均明显增强[15]。与此相应,抑制CWIN表达则会降低植物的抗病性。如通过RNA干扰技术抑制烟草中CWIN的表达导致植株对卵菌病原菌Phytophthora nicotianae的抗性降低[16]。但也有研究表明,CWIN在植物抗病性中发挥着负面作用。如番茄CWIN基因LIN8的沉默不仅没有降低番茄叶片的抗病性,反而增加对细菌性病菌Xanthomonas campestris pv.vesicatoria(Xcv)的抗性[17]。同样,通过超表达CWIN抑制因子的方法降低CWIN的活性导致拟南芥对真菌病菌Plasmodiophora brassicae的抗性增加[18]。因此,CWIN在植物抗病中的作用可能受植物和病菌种类的影响。
此外,其他蔗糖分解酶也在植物抗病中發挥重要作用。如酵母转化酶基因在烟草液泡中的超表达可以增强烟草对马铃薯Y病毒的抗性[19]。拟南芥的CIN突变体(Atcinv1)对根结线虫和孢囊线虫的抗性下降[20]。然而对小麦的研究表明,CIN基因Ta-A/N-Inv1的下调反而增强植株对条锈病病菌Puccinia striiformis的抗性[21]。因此,和CWIN类似,CIN在植物抗病中的作用可能同样受植物和病菌种类的影响。总之,蔗糖转化酶在植物抗病中发挥着重要作用,但其具体作用可能是正面的,也可能是负面的,可能受到不同植物或病原菌种类的影响。目前有关Sus在植物抗病中的作用研究则较少。
目前有关灰霉病对番茄叶片蔗糖分解代谢影响的研究较少。因此,笔者研究接种灰霉病后不同时期番茄叶片中蔗糖转化酶活性(CWIN、CIN和VIN)、可溶性糖含量(Suc、Glc和Fru)的动态变化,同时对淀粉和过氧化氢(H2O2)进行原位染色,以期鉴定出对灰霉病菌侵染响应最为敏感的转化酶种类,初步阐明蔗糖代谢在番茄抵抗灰霉病菌侵染的生理生化机制,为下一步通过转基因及分子育种等现代生物技术手段提高番茄对灰霉病的抗性提供参考。
1 材料与方法
1.1 材料
试验所用番茄品种为新疆农业科学院园艺研究所育成的“新番2号”。番茄栽培在海南大学实验基地塑料大棚内进行,将番茄种子消毒后播种到预先装满蛭石32孔的穴盘内。播种约30 d后,番茄幼苗达到4叶1心,此时将幼苗定植到花盆内(上、下部直径为25.4和17.8 cm,高19.7 cm),基质为田园土∶羊粪(1∶1),再加一定量复合肥(N∶P∶K=15∶15∶15)。每盆定植1株苗,共种植20株。番茄定植28 d后,取大小、形状和植株部位相同的番茄叶片进行灰霉病菌离体接种试验。
1.2 方法
1.2.1 灰霉病菌的培养和接种。
番茄灰霉病菌(B.cinerea)由海南大学植物保护学院刘铜教授惠赠。将灰霉病菌接种到V8培养基上培养,在黑暗、23 ℃恒温条件下培养约14 d后产生大量分生孢子。孢子悬浮液配制和离体接种均参照Lian等[22]的方法并作适当调整:用SMB液体培养基(1%蛋白胨,4%麦芽糖,pH 5.6)配制孢子悬浮液,调整孢子最终浓度至5×105/mL。在直径9 cm的培养皿中倒入25 mL浓度0.8%的琼脂,待琼脂凝固后将清洗干净的番茄叶片的叶柄嵌入琼脂中并保持叶片平整。在每片叶片的主脉两侧各接种3滴孢子悬浮液,每滴5 μL,密封后在黑暗条件下培养(23 ℃恒温)。对照则接种不含孢子的SMB液体培养基。在接种0、12、24和48 h后分别进行取样,用直径1 cm的打孔器以菌液滴为中心打孔取样并称重,液氮速冻后在-80 ℃下存放,用于酶活性和糖含量测定。每个处理含5个生物学重复。
1.2.2 蔗糖转化酶活性和可溶性糖含量的测定。
INV活性的测定参照Tomlinson等[23]的方法;蔗糖、葡萄糖、果糖含量的测定参照King等[24]的酶学方法。
1.2.3 细胞死亡染色。
番茄叶片在接种12、24和48 h后细胞死亡染色,具体方法参照Bai等[25]的方法。将番茄叶片在1∶1的乙醇和染色液(将10 mL乳酸、10 mL甘油、10 g苯酚和10 mg台盼蓝溶于10 mL蒸馏水中)配制的混合液中煮沸5 min进行染色,然后在2.5 g/mL的水合氯醛溶液中进行脱色处理,最后对叶片进行拍照。
1.2.4 淀粉和H2O2原位染色。
叶片淀粉染色参考Sosso等[26]的方法。将番茄叶片在95%乙醇中煮沸30 min将叶绿素完全去除,然后将叶片在I-KI溶液(将1 g 碘和1 g碘化钾溶于100 mL水中)中染色15 min,然后用清水冲洗2次,最后进行拍照记录。
叶片H2O2染色参考ThordalChristensen等[27]的方法,将番茄叶片放入1 mg/mL的DAB(3,3-diaminobenzidine)溶液中,在-80 kPa下抽真空7 min(共重复3次,中间轻轻振荡去除叶片表面的气泡),然后避光室温下放置30 min。最后在95%乙醇中煮沸10 min去除叶绿素后进行拍照,存在H2O2的部位在染色后呈棕红色。
1.3 数据处理
利用 Excel 2010软件对试验数据进行作图和t-test 分析。
2 结果与分析
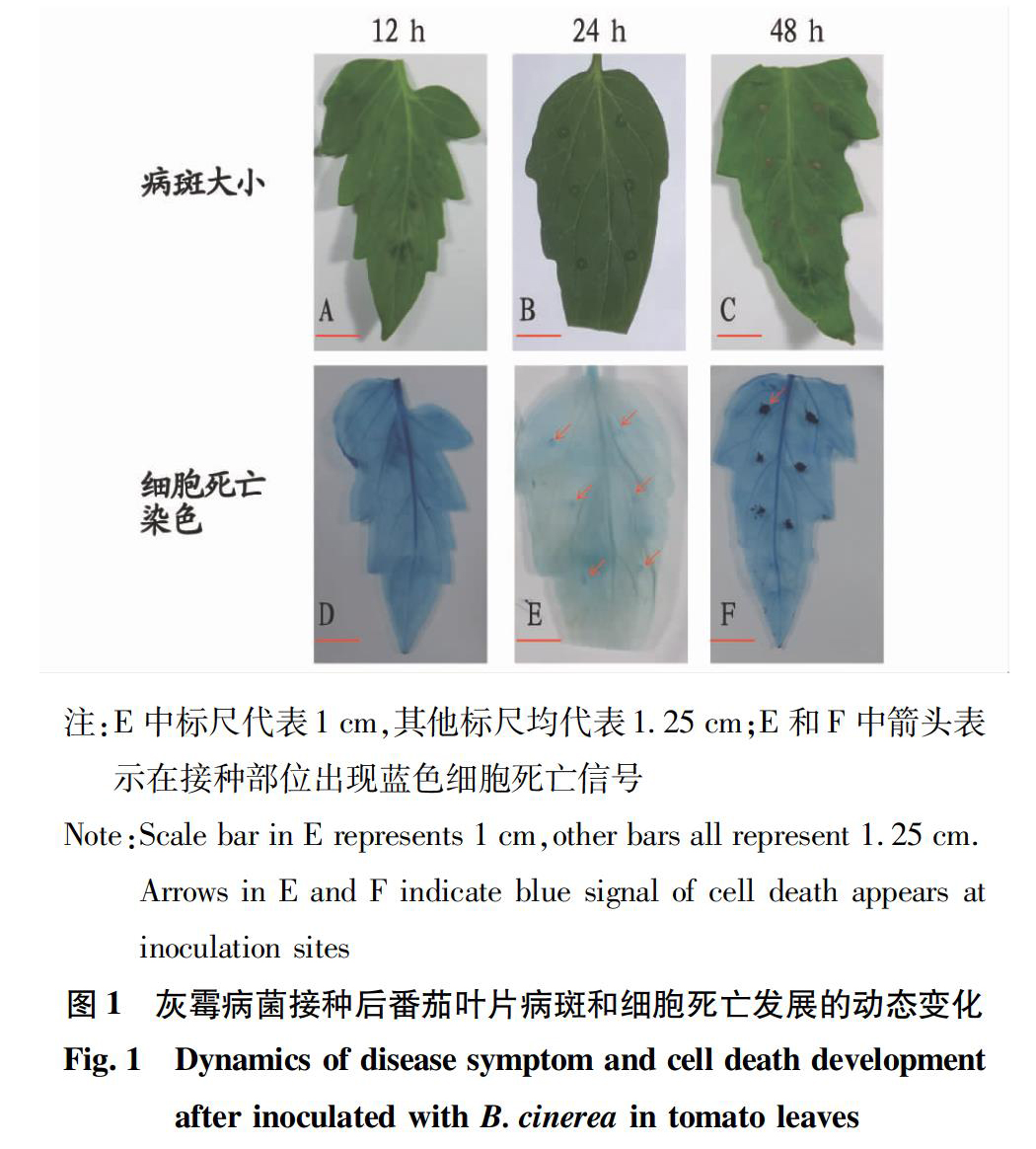
2.1 灰霉病菌接种不同时期病斑和细胞死亡情况
对接种后12、24、48 h的番茄叶片进行观察,发现在接种后12和24 h未出现肉眼可见的病斑,只是在48 h观察到明显病斑(图1)。在此基础上,进一步对上述4个时期的叶片进行台盼蓝染色,以观察叶片细胞死亡情况,发现在12 h,接种部位并未出现细胞死亡现象,但在24 h已经开始出现细胞死亡现象(图1中箭头所示),到48 h时细胞死亡出现的面积更大(图1)。这表明,虽然在接种后24 h叶片并未出现明显的病斑,但在接种部位已经开始发生细胞死亡现象,表明此时病菌已经成功侵染进入叶片细胞。在接下来的试验中,重点研究灰霉病菌侵染前2个时期(0和12 h)和侵染后2个时期(24和48 h)番茄叶片中蔗糖转化酶活性(CWIN、CIN和VIN)和可溶性糖(蔗糖、葡萄糖和果糖)含量的动态变化。
2.2 灰霉病菌侵染对番茄叶片转化酶活性的影响
对不同接种时期转化酶活性的测定表明,无论接种与否,叶片中的3种转化酶CWIN、CIN和VIN活性均呈快速上升趋势(图2)。但与对照相比,病菌接种情况下3种转化酶活性的上升幅度更大,表明病菌侵染诱导了3种转化酶的活性。进一步分析表明,CWIN活性在接种后12 h已经显著高于对照,在12、24和48 h分别较对照增加48%、31%和268%(图2A),而CIN在接种后24 h显著高于对照(图2B),在24和48 h分别较对照增加61%和101%;和CIN类似,VIN也是在接种后24 h显著高于對照,但仅比对照高31%,且其活性在接种后48 h和对照无显著差异(图2C)。上述证据表明,灰霉接种对3种转化酶活性均产生诱导效应,其中CWIN活性最先受到诱导,CIN和VIN活性随后受到诱导,且VIN活性受到诱导的时间较短;在3种转化酶中,CWIN和CIN活性受病菌诱导上升的幅度大于VIN。
2.3 灰霉病菌侵染对番茄叶片可溶性糖含量的影响
通常情况下,病菌侵染会诱导可溶性糖分在侵染部位的积累,从而为植物防御反应提供养分和能量[14]。因此,进一步测定番茄叶片接种部位中的可溶性糖含量(蔗糖、葡萄糖和果糖)。结果表明,3种可溶性糖含量在整个调查时期内(接种后0~48 h)均呈先上升后下降的变化趋势,但3种可溶性糖含量在接种叶片和对照叶片之间无显著差异,表明灰霉病菌接种对叶片中的可溶性糖含量无显著影响(图3A~C)。虽然与对照相比,接种后叶片中的可溶性糖含量没有变化,但己糖/蔗糖在接种后呈降低趋势,在接种后48 h显著低于对照(图3D)。由于高的己糖/蔗糖可诱导植物的抗病反应[14],因此己糖/蔗糖的降低可能会导致植物的抗病能力下降。
2.4 灰霉病菌侵染对番茄叶片淀粉和H2O2积累的影响
对叶片中的淀粉进行原位染色,结果发现在接种后0 h时,蓝黑色的淀粉信号均匀分布在整个叶片(图4A);在接种病菌24 h后叶片虽然没有病斑出现,但在接种部位已经出现蓝黑色信号消失的现象,表明接种部位的淀粉已经消耗殆尽;接种病菌48 h后,整个叶片的淀粉几乎被完全消耗,特别是在接种部位及其附近几乎没有淀粉信号的存在,只是离接种部位较远的部位还有少量淀粉存在。对照叶片在培养48 h后蓝黑色的淀粉信号只是出现微弱的下降,而且淀粉信号均匀分布于整个叶片(数据未列出)。上述结果表明,灰霉病菌接种会导致接种部位及其附近的淀粉含量大幅下降。
此外,对叶片H2O2的原位染色表明,在接种后0 h时,在叶片中未检测到任何棕红色的H2O2信号(图4B)。在接种病菌24 h后叶片虽然没有病斑出现,但在接种部位已经检测到H2O2信号;在接种病菌48 h后,伴随着病斑的出现H2O2信号显著增强,但主要局限于接种部位,只是在紧邻接种部位的地方出现微弱的H2O2信号。对照叶片在培养48 h后并未出现明显的H2O2信号(数据未列出)。上述结果表明,灰霉病菌接种会导致接种部位H2O2含量大幅上升。
3 结论与讨论
蔗糖分解代谢不仅可以为植物的防御反应提供能量和碳骨架用于各种抗菌物质的合成,也可以作为信号分子调控植物抗病基因的表达[14];此外,病菌生长发育所需的糖分也来自于植物蔗糖的分解,因为绝大部分植物病原菌包括灰霉病菌主要是利用葡萄糖和果糖作为其能量来源[28-29]。因此,植物体内的蔗糖分解酶在植物抗病中发挥着重要作用。目前研究主要集中在转化酶特别是CWIN在植物抗病中的作用[30]。
目前仍不清楚蔗糖转化酶在番茄抵御灰霉病侵染中的具体作用。笔者系统研究了灰霉病菌侵染对番茄叶片中3种转化酶(CWIN、CIN和CIN)活性的影响,结果发现灰霉病菌侵染会显著诱导番茄叶片中3种转化酶活性的上升。这和其他研究中的发现类似。如辣椒接种Xanthomonas campestris pv.vesicatoria(Xcv)后,其叶片中的CWIN和VIN活性持续增加,同样烟草叶片接种Xcv后,CWIN活性也显著增加[31]。通过进一步分析表明,首先,3种转化酶活性受到病菌侵染诱导的时期不同。其中CWIN转化酶活性受到诱导的时间最早(接种后12 h),而CIN和VIN活性受到诱导的时间较晚(接种后24 h)。值得注意的是,CWIN活性的上升发生在叶片细胞死亡出现之前(接种后12 h),而CIN和VIN活性的上升则出现在叶片细胞死亡之后(接种后24 h)。此外,虽然CIN和VIN的活性都是在接种后24 h受到诱导,但CIN的诱导可持续到接种后48 h,而VIN活性在接种后48 h时和对照已无显著差异。其次,3种转化酶在病菌侵染后上升的幅度不同。其中CWIN活性最高比对照增加268%,CIN最高比对照增加101%,而VIN最高仅比对照增加31%。因此,从活性诱导时期和活性上升幅度来看,CWIN对灰霉病菌侵染响应最为灵敏,其次为CIN,最后为VIN。这表明和CIN与VIN相比,CWIN可能在番茄-灰霉病菌互作中发挥着更为重要的作用。
转基因证据表明蔗糖转化酶特别是CWIN在植物抗病中发挥着重要作用,但受不同植物或病菌种类的影响,其具体作用可能是正面的,也可能是负面的。该研究结果表明,虽然接种后转化酶活性的大幅上升,但植物仍出现严重的病症,表明病菌侵染所诱导的转化酶活性上升似乎更有利于灰霉病菌的发育,而不利于植物的抗病性。有观点认为,CWIN活性的小幅上升可为病菌生长发育提供更多的己糖,从而降低植物的抗病性,而CWIN活性的大幅上升才能产生足够的己糖信号来激活植物的抗病反应[14,32]。如接种病菌Pst DC3000后,抗病拟南芥植株叶片中的CWIN活性上升幅度遠高于不抗病拟南芥植株[33]。细菌性病害Xanthomonas campestris pv.vesicatoria(Xcv)甚至可以向辣椒细胞中分泌一种致病蛋白因子来抑制辣椒CWIN活性的上升,从而降低辣椒的抗病能力[31]。在该研究中,CWIN活性在接种后12 和24 h分别上升48%和31%,只有在接种后48 h才大幅上升268%。同样CIN活性在接种后24 h上升61%,而在48 h大幅上升101%。这表明CWIN和CIN在病菌侵染早期活性上升幅度较小,这可能会促进灰霉病菌的生长发育,导致植物发病。对叶片中己糖/蔗糖的测定也验证了此推论,病菌侵染后番茄叶片中的己糖/蔗糖比值呈下降趋势,表明CWIN和CIN活性的小幅上升并不能提高己糖/蔗糖,因此不能激活植物的抗病反应。
伴随着转化酶活性的上升,灰霉病菌侵染并没有改变叶片中蔗糖、葡萄糖和果糖的含量。类似的现象也存在于其他植物病菌互作系统中。如水稻和拟南芥分别受到水稻白叶枯菌(Xanthomonas oryzae pv.oryzae)和Pst DC3000的侵染后,其叶片中的可溶性糖含量都未发生显著变化[34-35]。虽然糖分含量未发生变化,但糖分消耗速率可能已经发生了较大变化。因为在接种24和48 h后,接种部位及其附近的淀粉含量大幅下降,表明灰霉病菌侵染导致叶片对糖分的消耗速率显著增加。一般认为,植物叶片中储存的淀粉在被植物利用之前需要首先转化为蔗糖运输到需要糖分的部位,然后蔗糖被进一步分解为葡萄糖和果糖用于植物的生长发育[14]。但该研究揭示伴随着病菌侵染和淀粉含量的下降,番茄叶片中的蔗糖或己糖(葡萄糖和果糖)含量并未显著上升。可能的合理解释就是接种后转化酶活性的大幅上升可迅速将蔗糖分解为葡萄糖和果糖,而葡萄糖和果糖又被植物或病菌快速的消耗利用。因此,虽然病菌侵染导致淀粉含量下降,但并没有出现可溶性糖含量显著升高的现象。
作为防御反应之一,植物受到病原菌侵染时会增强其清除活性氧的能力,从而避免活性氧过量积累所导致的植物细胞死亡[36]。灰霉病原菌是一种腐生型病原菌,叶片细胞的死亡可为其提供包括糖分在内的其他许多养分,从而增加其致病性[37]。该研究对番茄叶片细胞死亡和H2O2的原位染色表明,接种灰霉病菌24 h后,虽然还不能肉眼观察到番茄叶片上病斑的出现,但此时已经发生明显的细胞死亡和H2O2积累现象。这表明番茄叶片不能及时有效清除活性氧和避免细胞死亡的出现,最终导致灰霉病的发生。
参考文献
[1] 邱珂.甲基营养型芽孢杆菌Lw-6防治灰霉病研究[D].杨凌:西北农林科技大学,2018.
[2] 张敏,段海,马超,等.木霉菌防治番茄灰霉病田间药效试验[J].植物医生,2007,20(6):30-31.
[3] 张庆萍,王燕春,王秀琴,等.番茄灰霉病发生特点及室内毒力测定[J].北方农业学报,2018,46(2):69-72.
[4] 黄海,张鑫,邹杭,等.番茄灰霉病菌室内毒力测定及药效试验[J].西北农林科技大学学报(自然科学版),2015,43(2):184-190.
[5] 武东霞.灰葡萄孢菌(Botrytis cinerea)对苯噻菌酯和咯菌腈的抗药性风险研究[D].南京:南京农业大学,2015.
[6] 刘圣明,周明国,段亚冰,等.设施蔬菜灰霉病抗药性分子检测及精准防控关键技术研究与应用[R].河南科技大学,2017.
[7] 吕婷.番茄灰霉病拮抗菌筛选及复合生物海藻液肥研制[D].杭州:浙江大学,2018.
[8] 宁玉波.灵芝多糖的提取及对番茄抗灰霉病诱导效应的研究[D].泰安:山东农业大学,2016.
[9] 陳治芳,王文桥,韩秀英,等.新杀菌剂对番茄灰霉病菌的室内毒力及田间防效[J].植物保护,2011,37(5):193-195,205.
[10] BERGER S,SINHA A K,ROITSCH T.Plant physiology meets phytopathology:Plant primary metabolism and plantpathogen interactions[J].Journal of experimental botany,2007,58(15/16):4019-4026.
[11] RICO A,PRESTON G M.Pseudomonas syringae pv.tomato DC3000 uses constitutive and apoplastinduced nutrient assimilation pathways to catabolize nutrients that are abundant in the tomato apoplast[J].Molecular plantmicrobe interactions,2008,21(2):269-282.
[12] 卢合全,沈法富,刘凌霄,等.植物蔗糖合成酶功能与分子生物学研究进展[J].中国农学通报,2005,21(7):34-37,57.
[13] 张明方,李志凌.高等植物中与蔗糖代谢相关的酶[J].植物生理学通讯,2002,38(3):289-295.
[14] RUAN Y L.Sucrose metabolism:Gateway to diverse carbon use and sugar signaling[J].Annual review of plant biology,2014,65:33-67.
[15] SUN L,YANG D L,KONG Y,et al.Sugar homeostasis mediated by cell wall invertase GRAIN INCOMPLETE FILLING1(GIF1) plays a role in preexisting and induced defence in rice[J].Molecular plant pathology,2014,15(2):161-173.
[16] ESSMANN J,SCHMITZTHOM I,SCHN H,et al.RNA interferencemediated repression of cell wall invertase impairs defense in source leaves of tobacco[J].Plant physiology,2008,147(3):1288-1299.
[17] KOCAL N,SONNEWALD U,SONNEWALD S.Cell wallbound invertase limits sucrose export and is involved in symptom development and inhibition of photosynthesis during compatible interaction between tomato and Xanthomonas campestris pv vesicatoria[J].Plant physiology,2008,148(3):1523-1536.
[18] SIEMENS J,GONZALEZ M C,WOLF S,et al.Extracellular invertase is involved in the regulation of clubroot disease in Arabidopsis thaliana[J].Molecular plant pathology,2011,12(3):247-262.
[19] HERBERS K,MEUWLY P,FROMMER W B,et al.Systemic acquired resistance mediated by the ectopic expression of invertase:Possible hexose sensing in the secretory pathway[J].The plant cell,1996,8(5):793-803.
[20] CABELLO S,LORENZ C,CRESPO S,et al.Altered sucrose synthase and invertase expression affects the local and systemic sugar metabolism of nematodeinfected Arabidopsis thaliana plants[J].Journal of experimental botany,2013,65(1):201-212.
[21] LIU J,HAN L N,HUAI B Y,et al.Downregulation of a wheat alkaline/neutral invertase correlates with reduced host susceptibility to wheat stripe rust caused by Puccinia striiformis[J].Journal of experimental botany,2015,66(22):7325-7338.
[22] LIAN J J,HAN H Y,ZHAO J H,et al.Invitro and inplanta Botrytis cinerea inoculation assays for tomato[J/OL].The plant cell,2018,8(8):e2810[2019-12-05].https://bioprotocol.org/e2810.DOI:10.21769/BioProtoc.2810.
[23] TOMLINSON K L,MCHUGH S,LABBE H,et al.Evidence that the hexosetosucrose ratio does not control the switch to storage product accumulation in oilseeds:Analysis of tobacco seed development and effects of overexpressing apoplastic invertase[J].Journal of experimental botany,2004,55(406):2291-2303.
[24] KING S P,LUNN J E,FURBANK R T.Carbohydrate content and enzyme metabolism in developing canola siliques[J].Plant physiology,1997,114(1):153-160.
[25] BAI S W,LIU J,CHANG C,et al.Structurefunction analysis of barley NLR immune receptor MLA10 reveals its cell compartment specific activity in cell death and disease resistance[J].PLoS Pathogens,2012,8(6):1-16.
[26] SOSSO D,VAN DER LINDE K,BEZRUTCZYK M,et al.Sugar partitioning between Ustilago maydis and its host Zea mays L.during infection[J].Plant physiology,2019,179(4):1373-1385.
[27] THORDALCHRISTENSEN H,ZHANG Z G,WEI Y D,et al.Subcellular localization of H2O2 in plants.H2O2 accumulation in papillae and hypersensitive response during the barleypowdery mildew interaction[J].The plant journal,1997,11(6):1187-1194.
[28] VEILLET F,GAILLARD C,COUTOSTHVENOT P,et al.Targeting the AtCWIN1 gene to explore the role of invertases in sucrose transport in roots and during Botrytis cinerea infection[J/OL].Frontiers in plant science,2016,7[2019-12-05].https://doi.org/10.3389/fpls.2016.01899.
[29] JULIUS B T,LEACH K A,TRAN T M,et al.Sugar transporters in plants:New insights and discoveries[J].Plant and cell physiology,2017,58(9):1442-1460.
[30] TAUZIN A S,GIARDINA T.Sucrose and invertases,a part of the plant defense response to the biotic stresses[J].Frontiers in plant science,2014,5:293.
[31] SONNEWALD S,PRILLER J P R,SCHUSTER J,et al.Regulation of cell wallbound invertase in pepper leaves by Xanthomonas campestris pv.vesicatoria type three effectors[J].PLoS One,2012,7(12):1-16.
[32] BEZRUTCZYK M,YANG J,EOM J S,et al.Sugar flux and signaling in plantmicrobe interactions[J].The plant journal,2018,93(4):675-685.
[33] TAO Y,XIE Z Y,CHEN W Q,et al.Quantitative nature of Arabidopsis responses during compatible and incompatible interactions with the bacterial pathogen Pseudomonas syringae[J].The plant cell,2003,15(2):317-330.
[34] CHEN L Q,HOU B H,LALONDE S,et al.Sugar transporters for intercellular exchange and nutrition of pathogens[J].Nature,2010,468(7323):527-534.
[35] YAMADA K,SAIJO Y,NAKAGAMI H,et al.Regulation of sugar transporter activity for antibacterial defense in Arabidopsis[J].Science,2016,354(6318):1427-1430.
[36] LIU Y H,OFFLER C E,RUAN Y L.Regulation of fruit and seed response to heat and drought by sugars as nutrients and signals[J].Frontiers in plant science,2013,4:1-12.
[37] GREENBERG J T,YAO N.The role and regulation of programmed cell death in plantpathogen interactions[J].Cellular microbiology,2004,6(3):201-211.
- 运用微信新媒体,搭建农村学校家校对话新平台
- 给学生一双隐形的翅膀
- 如何走入诗人的情感世界
- 渗透传统文化 彰显别样风采
- 试论初中语文教学中传统节日文化的渗透
- 简析职高语文教学中的情感教育构建
- 语文教学中如何培养学生的核心素养
- 基于素质教育要求打造初中语文阅读教学的相关思考
- “走进家乡”语文综合实践活动的教与思
- 小学语文多媒体教学课件制作及应用
- 人文教育在高中语文教学中的重要性分析
- 蔡元培美育思想在散文阅读教学中的运用
- 有效培养学生语文核心素养
- 综合实践活动存在的问题及对策
- 如何在小学语文古诗文教学中渗透审美教育
- 引影视资源之水 入名著阅读之渠
- 小学语文教学探讨
- 紧抓职高语文文本,构建和谐亲子关系
- 审美与人格
- 如何在小学语文教学中渗透核心素养
- 试论情感教育对小学语文教师素质的要求
- 让微课助力小学语文教学目标的达成
- 生命关怀教育及其在小学语文教学中的应用
- 创设恰当情境 建构魅力高职诗歌课堂
- 高中语文教学现状及改进策略
- directdeposit
- directdialling
- directed
- directee
- directer
- directest
- directexport
- directimport
- directing
- directinvestment
- direction
- directional signals
- directionlessness
- directionlessnesses
- directions
- directive
- directively
- directiveness
- directives
- directlabour
- directly
- direct mail
- direct-mail
- directmail
- direct mailing
- 关公卖秤砣——人硬货也硬
- 关公卖豆腐
- 关公在曹营——心不在焉
- 关公开刀铺
- 关公开刀铺——货真价实
- 关公当木匠
- 关公当木匠——大刀阔斧
- 关公战秦琼——从何说起
- 关公战秦琼——挨不上
- 关公战秦琼——没那回事儿
- 关公打喷嚏——自我吹须
- 关公打财神——财发足了
- 关公放屁——不知脸红
- 关公斗李逵
- 关公斗李逵——大刀阔斧
- 关公斗李逵——开口不客气
- 关公老子——满面红
- 关公脖子挂葫芦——脸红脖子粗
- 关公舞大刀
- 关公舞大刀——拿得起,放得下
- 关公舞大刀——拿手好戏
- 关公走麦城
- 关公走麦城——倒霉了
- 关公走麦城——前景不妙
- 关公走麦城——死到临头