巧用“微课”解难题
黄瑶
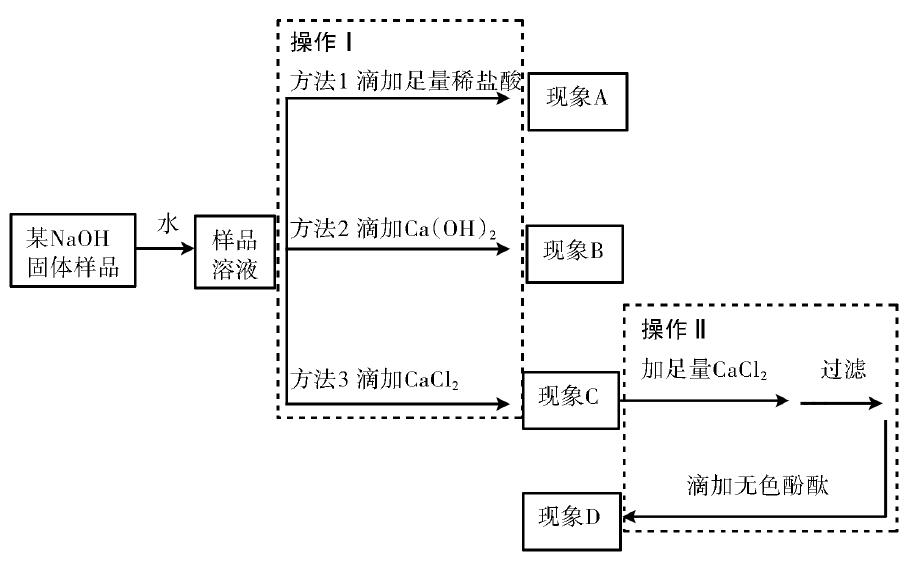
在人教版第十一单元课题一“生活中常见的盐”课后习题中,有一道练习题要求学生设计实验方案探究氢氧化钠的变质问题.在讲授此题后,通过作业反馈发现学生的答题效果并不理想.通过不断的学习和思考,针对氢氧化钠的变质问题自己制作了一段时长8分钟的“微课”,从认识变质原因、判断是否变质及探究变质程度三个方面,对知识进行了整理归纳,强化并巩固了学生对氢氧化钠变质问题的认识和理解.
一、认识氢氧化钠变质的原因
利用“微课”,首先回顾了氢氧化钠的相关性质:NaOH,俗名叫烧碱、火碱、苛性钠,是一种白色片状固体,敞口放置易吸收空气中的水分而潮解,继而与空气中的二氧化碳反应,生成碳酸钠和水.
利用上述信息學生掌握了氢氧化钠变质的原因,对于某氢氧化钠样品,如何判断该氢氧化钠是否发生了变质呢?接下来,“微课”从判断依据和方法策略两个方面阐述了判断氢氧化钠是否变质的过程.
二、判断氢氧化钠是否变质
1.判断依据:氢氧化钠样品中是否有碳酸钠生成.
2.方法策略:根据碳酸钠的性质,要选择能与碳酸钠反应,且能产生明显现象的物质,具体方法如下.
(1)加酸:加入足量的稀盐酸或稀硫酸,观察是否有气泡产生.如果有气泡产生,说明样品已经变质;如果没有产生气泡,则说明样品没有变质.
(2)加碱:加入Ca(OH)2溶液或Ba(OH)2溶液,观察是否有白色沉淀产生.如果有白色沉淀产生,说明样品已经变质;如果没有产生沉淀,则说明样品没有变质.
(3)加盐:加入CaCl2溶液或Ca(NO3)2溶液或BaCl2溶液或Ba(NO3)2溶液,观察是否有白色沉淀产生.如果有白色沉淀产生,说明样品已经变质;如果没有产生沉淀,则说明样品没有变质.
利用上述方法能判断氢氧化钠是否发生变质,若氢氧化钠发生了变质,那么变质的程度该如何分析呢?然后“微课”从判断依据和方法策略两个方面阐述了NaOH的变质程度.
三、判断NaOH的变质程度
1.判断依据:样品中是否还有氢氧化钠存在.
2.方法策略:根据氢氧化钠的性质,可选用无色酚酞来检验样品中是否存在氢氧化钠,但变质的氢氧化钠中含有碳酸钠、碳酸钠溶液呈碱性,也能使无色酚酞变红.所以,在证明氢氧化钠存在之前,要首先排除碳酸钠对实验的干扰.若最终证明样品中有NaOH存在,则样品部分变质;若证明样品中没有NaOH存在,则样品全部变质.具体方法如下:
首先,加入足量的CaCl2溶液或BaCl2溶液或Ca(NO3)2溶液或Ba(NO3)2溶液,将碳酸钠转化为沉淀,从而将碳酸钠除去.其次,检验氢氧化钠的存在.向反应后的溶液中加入几滴酚酞试剂,观察溶液是否变红.如果溶液变红,说明有NaOH存在,样品部分变质;如果溶液不变红,则说明没有NaOH存在,样品全部变质.
接下来,“微课”从某氢氧化钠固体样品为起点开始分析,对氢氧化钠是否变质及变质程度的判断进行了整理归纳,进一步巩固学生对氢氧化钠变质问题的认识.
四、方法归纳
对于某氢氧化钠样品,如果样品为固体,通常配成溶液来进行实验,首先进行的操作是判断氢氧化钠是否变质,可以采用3种不同的方法,分别加入合适的酸、碱、盐(下图各举一例),通过观察实验现象A、现象B、现象C来判断氢氧化钠是否变质.如果实验说明该样品已经变质,可以继续在第三种方法的基础上进行下一步操作,要首先排除Na2CO3对实验的干扰,然后再利用酚酞检验NaOH的存在,通过观察实验现象D来判断氢氧化钠的变质程度.
最后,“微课”针对第十一单元课题一“生活中常见的盐”课后习题的第四题进行了详细的分析与解答,帮助学生进一步理清氢氧化钠变质问题的探究思路,并完善设计实验方案.
通过播放“微课”,利用框图的形式,系统、全面地帮助学生对氢氧化钠的变质问题进行了查缺补漏,即拓展了学生的视野,又提高了学生的学业水平,巩固了学生对氢氧化钠变质问题的认识和理解.

