活细胞成像系统在创新实践课程教学中的应用
王小利 杨怡姝 刘思杨 郑雨晨 肖向茜
摘 ?要 探索大型仪器设备活细胞成像系统用于生物技术专业创新实践课程的教学方式。以核转录因子κB信号通路知识点讲述为例,从专业知识、检测原理、实验设计、操作规程、实验结果等方面,系统阐述将活细胞成像系统引入创新实践课程的教学方案。课程教学与科学研究紧密联系,培养了学生的创新意识和实践能力。
关键词 活细胞成像系统;创新实践课程;大型仪器;实验
中图分类号:G642.3 ? ?文献标识码:B
文章编号:1671-489X(2019)16-0009-03
Application of Live Cell Imaging System in Teaching of Innova-tive Practice Courses//WANG Xiaoli, YANG Yishu, LIU Siyang, ZHENG Yuchen, XIAO Xiangqian
Abstract The innovative practice course is an important and nece-ssary for undergraduate students. Live cell image system is an ad-
vanced and precision instrument in life science. The teaching prac-tice of the instrument was described in innovative practice course. Taking the knowledge of nuclear transcription factor κB signal path-
way as an example, the paper was systematically introduced the tea-
ching plan from professional knowledge, instrument working prin-ciple, experimental design, instrument operation, and experimental results analysis. The class design combines the basic knowledge and
scientific research tightly, which cultivates the innovative and prac-tical ability of the students.
Key words live cell image system; innovative practice course; large-
scale instruments; experiment
1 引言
创新实践课程是高校本科生教学的主要组成部分,旨在激发学生创新意识,促进学生将理论知识应用于实际,培养学生创新实践能力[1]。生物技术专业本科生创新实践要求运用生物学技术解决生命科学领域的问题。将先进大型儀器面向本科生开放,并将其运用到本科生创新实践课程教学中,对激发学生学习兴趣、提高课程质量、培养学生实践探索能力具有重要的意义[2]。
活细胞成像系统是生命科学领域先进的精密仪器,在多种前沿研究中广泛应用[3]。该仪器提供了细胞培养的环境,可对样本长时间进行多点、多层动态全自动扫描拍摄,可长时间记录细胞的增殖、运动、分化和迁移等现象,对细胞荧光标记蛋白的长时程示踪进行观察。该仪器应用领域和生物技术专业知识密切相关,设计合适的教学实验,将该仪器面向该专业本科生开放,对提高学生的专业技能、开阔学生视野具有重大意义。
核转录因子-κB(nuclear factor κB,NF-κB)信号通路参与机体细胞免疫应答、炎症反应、细胞生长发育及凋亡等多种生物学过程[4],是生物技术专业的重要知识点。运用活细胞成像系统,设计教学方案,观察记录NF-κB的转运,开展创新实践课程,不仅可以加深学生对知识点的理解和综合运用,而且可以培养学生利用现有实验条件进行实验设计、实施、分析的能力,提高学生的创新探索水平。
2 实验设计
NF-κB由Rel蛋白家族多种蛋白组成,p65蛋白是其中一种重要的蛋白。NF-κB在细胞中多以二聚体复合物存在,胞质中NF-κB与抑制性κB(inhibitor of NF-κB,IκB)蛋白结合,呈现为非活性状态。当NF-κB被肿瘤坏死因子α(tumor necrosis factor,TNFα)[12]、蛋白激酶C(protein
kinase C,PKC)、蛋白激酶A(protein kinase A,PKA)等因素激活,与IκB蛋白解离,向胞核易位,结合到基因转录调控区,激活基因转录[5]。本研究将表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)
的质粒(pEGFP-C3)和融合表达p65蛋白的质粒pEGFP-p65,分别转染HeLa细胞24 h后,用活细胞成像系统实时监测EGFP-p65融合蛋白和EGFP蛋白在细胞中表达的动态变化。
3 实验材料与仪器
pEGFP-p65重组质粒、pEGFP-C3质粒、HeLa细胞由本实验室保存;转染试剂FuGENE 6购自Promega公司,DMEM细胞培养基和胎牛血清购自GIBCO公司,TNFα购自Sigma公司。活细胞成像系统购自ZEISS公司,型号为Cell Ob-server SD。
4 实验方法
活细胞成像系统概述 ?首先介绍仪器的组成系统及功能。本实验室的活细胞成像系统为ZEISS SD型,组成包括荧光显微成像系统、激光光源系统、CO2温控系统、电动载物台微细胞培养室和图像采集处理系统等部分。CO2温控系统和电动载物台微细胞培养室提供了37 ℃、5% CO2细胞培养环境,可对样本长时间进行多点、多层动态全自动扫描拍摄。激光光源系统和荧光显微成像系统是仪器的成像系统。多个激光管提供多个激发波长,转盘扫描头可多点同步扫描。转盘上有多个螺旋排列的针孔,激光激发扫描区样品,发射光通过转盘上的针孔与激发光照射点共轭,滤除非焦平面杂散光。多个针孔,相当于多个激光点同步照射样品,同步激发,相机同步采集,实现对样品的快速扫描。该仪器成像速度快、立体感强、光毒性小,可实现细胞运动的实时监测和多位点成像。AxioVision Rel 4.8数据处理系统全自动控制图像拍摄采集,并对获取的数据进行分析,可进行样本的三维重组和荧光强度的动态分析。
活细胞成像系统开机与调试 ?依次打开总电源开关,激光控制电源、CO2温控系统、显微镜控制开关、电动载物台控制系统、荧光光源、图像采集系统、电脑主机,开启活细胞成像系统。根据需要开启相应激光管电源,本实验使用488 nm激光管。打开控制软件AxioVision Rel 4.8,调试光路系统。
样本的制备 ?将pEGFP-p65质粒和EGFP-C3对照质粒分别转染HeLa细胞,放进活细胞成像微型培养箱中,37 ℃、5% CO2条件下培养。40×物镜下选取合适视野,调整焦距,设定曝光时间,实时采集图像。24 h后,加入10 ng/mL的TNFα,继续实时采集图像24 h。
图像实时采集 ?设定图像采集程序。点击Multidimen-sional Acquisition菜单,Channel 1选择明场40×DIC,采集光镜下图像;Channel 2选择GFP参数,采集绿色荧光信号,设置各通道最佳曝光时间。纵向分层扫描,Z菜单中设定层间隔为1 μm,Z轴起止焦平面位置;检测持续时间T菜单中,采集间隔为5 min,时长为连续24 h。点击Start按钮,开始动态检测绿色荧光信号。
图像采集结果分析 ?点Resample按钮,选择第0 h,1 h,
…,24 h时点,输出所有层图像。点Cut View菜单,选取“Create TL image”,输出各时点的正交显示图像,叠加各层荧光信号。Outline工具选中荧光细胞的细胞核区和整个细胞区,单击鼠标右键,选“Properties”,在Mea-
surement菜单中勾选“All T”,输出选中区域荧光的灰度值,用GraphPad Prism 6.0软件分析荧光强度。
5 实验结果与讨论
专业背景知识介绍 ?本创新实践课程的知识点涉及细胞生物学中信号通路的传导、基因工程中的克隆构建及表达等基础理论,还涉及细胞培养、分子生物学实验、显微镜操作等实验技术。因此,在课程教学时首先引导学生将在不同课堂中学习到的零散知识点串联起来,之后着重讲解荧光显微镜的成像及工作原理,掌握活细胞成像系统的操作、分析方法。在此基础上,指导学生进行实验设计,观察记录TNFα对NFκB信号通路的影响。本实验将基因克隆、蛋白表达、细胞培养、荧光成像和细胞结构等相关知识进行综合应用,将常用生物学技术与大型生物学仪器使用操作进行有机整合,实现理论知识与科研实践的有机融合。
绿色荧光蛋白的示踪作用 ?EGFP是生物学领域常用的报告蛋白,由488 nm激光激发,发出绿色荧光,可通过荧光显微镜检测。EGFP常与其他蛋白序列一起构造成融合蛋白,示踪靶蛋白的表达和定位。将pEGFP-p65质粒转染HeLa细胞,可直观研究NF-κB在细胞中的定位改变。
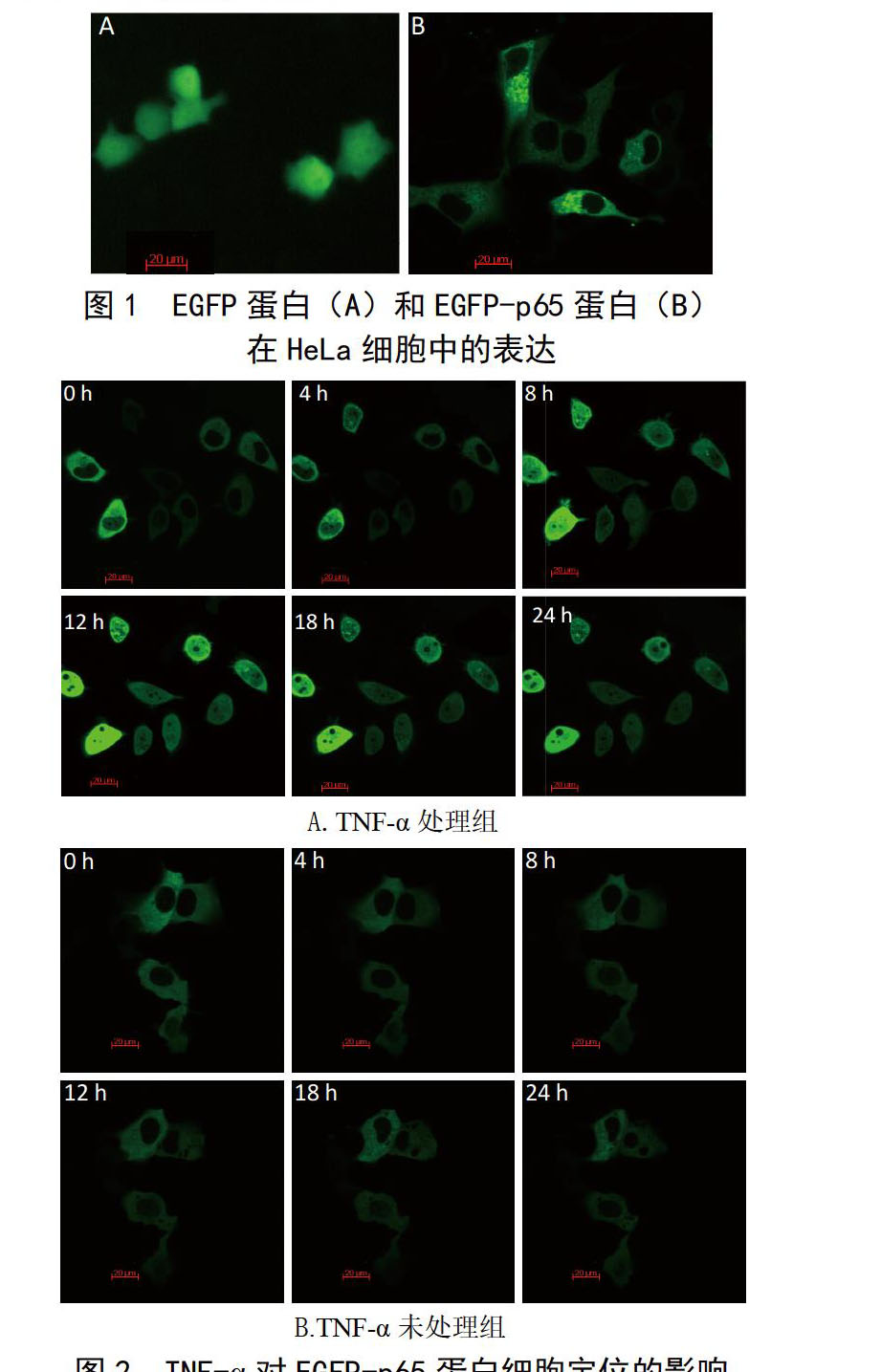
NF-κB蛋白主要分布在细胞质中 ?将pEGFP-p65质粒和pEGFP-C3对照质粒转染HeLa细胞。24 h后,对照质粒组,细胞质和细胞核中呈现弥散绿色,而pEGFP-p65质粒组只有细胞质中呈绿色,细胞核处呈暗色,核边缘清晰,提示EGFP蛋白弥散表达在胞浆和胞核,而EGFP-p65融合蛋白主要分布在细胞质中(图1)。
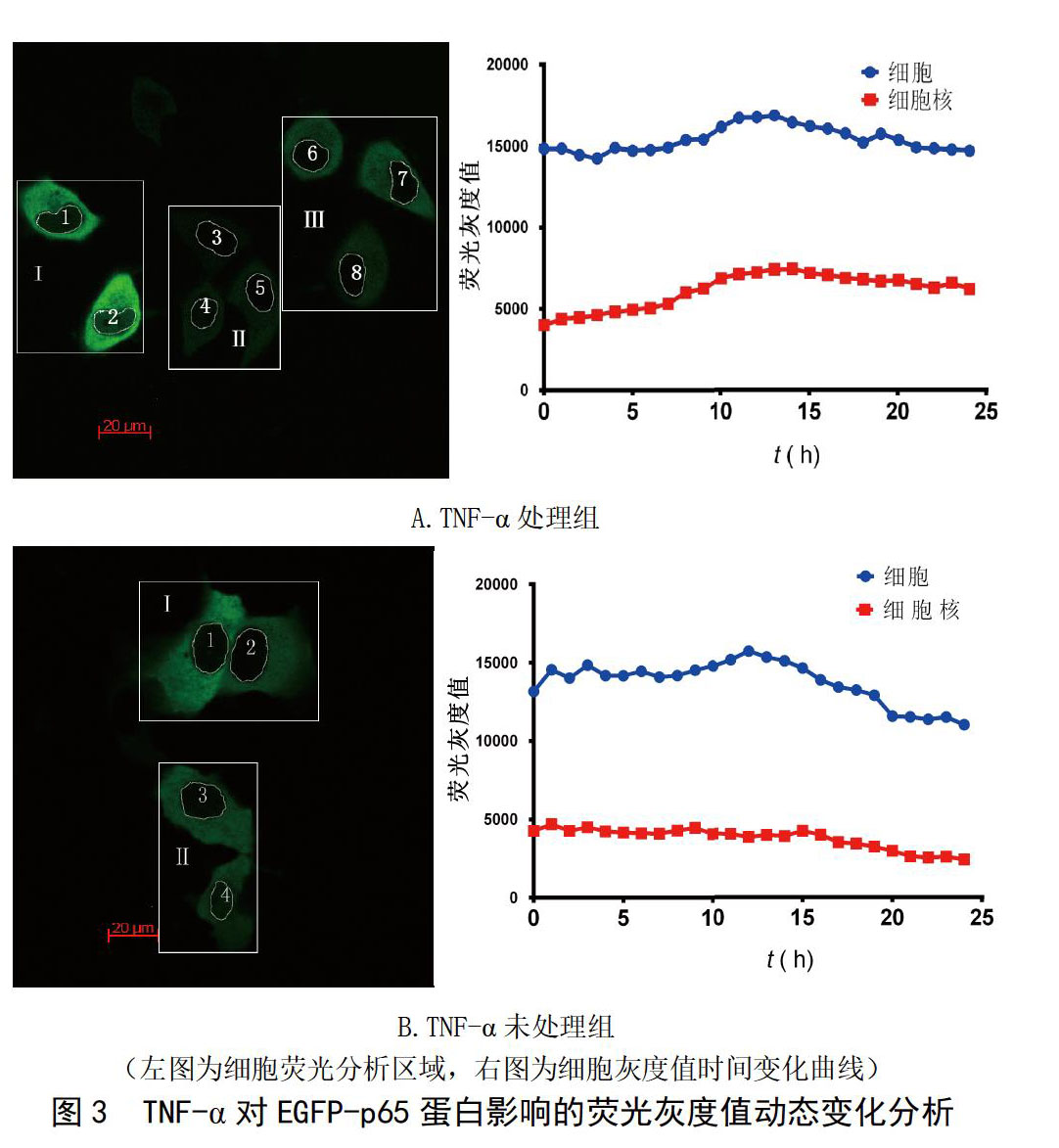
TNFα促进NF-κB从胞质转移到胞核 ?pEGFP-p65质粒转染HeLa细胞24 h后,加入TNF-α處理,实时监测融合蛋白变化。TNFα处理组,随着共孵育时间延长,细胞核中逐渐呈现绿色,核边缘模糊,直至核中亦弥散绿色(图2A)。而TNFα未处理组,绿色荧光始终存在于胞质中(图2B)。结果表明,TNFα可以促进p65蛋白由胞质向胞核易位。两组实验中,在共孵育12 h后,细胞荧光强度有衰减现象。
对实时采集的图片用AxioVision Rel 4.8软件进行分析。随机选取几个视野,依次标记为Ⅰ、Ⅱ等,每个视野圈出细胞核区,标记为1、2、3等,定量计算细胞核和细胞总荧光强度随时间变化的灰度值。TNFα处理组(图3A),细胞核内的荧光灰度值逐渐增强,12 h左右达到最强,随后略有降低;共孵育前12 h,细胞总荧光灰度值保持稳定,随后灰度值略下降。没有TNFα组(图3B),细胞核荧光灰度值随时间变化不明显,细胞总荧光灰度值在记录后期(12 h后)略有下降。荧光灰度值定量分析与显微镜记录结果一致。记录后期细胞荧光强度降低的原因,推测可能是荧光淬灭,或者是蛋白表达时间过长引起的细胞毒性。
活细胞成像系统检测注意事项 ?活细胞成像系统是大型精密仪器,价格昂贵,应经过系统培训方能使用,且操作应严格遵守操作规程。主要注意:仪器放置空间要洁净,室内不要有对流气流,要防震,保证暗室环境;镜头要保持清洁,用后要及时清除镜油;注意开关机顺序等。
6 结语
本实验根据创新实践课的要求,既考虑本科生的知识背景,又注重前沿和探索,与科学研究相结合,设计实验方案,利用先进的大型生物仪器实施教学。教学过程中教师启发、讲解和学生操作实践相结合,充分调动学习的积极性,将细胞生物学、分子生物学、显微成像技术等知识有机串联在一起,使深奥抽象的知识利用活性细胞成像系统直观呈现出来,加深学生对知识的理解和应用,了解活细胞成像系统的操作技术和常用领域。课堂气氛活跃,学生兴趣浓厚,反响热烈,教学效果良好。
参考文献
[1]汤云晖,王波,李耳.培养本科生创新能力的创新实践课教学[J].中国现代教育装备,2012(5):62-64.
[2]乔光,洪怡.大型仪器设备在本科实验教学中使用问题的探讨[J].实验室科学,2017,20(4):207-209.
[3]DANCE A. Live-cell imaging: Deeper, faster, wider
[EB/OL].[2018-03-27].https://www.sciencemag.org/fea
tures/2018/03/live-cell-imaging-deeper-faster-wider.
[4]ZHANG Q, Lenardo M J, Baltimore D. 30 years of NF-
κB: a blossoming of relevance to human pathobiology
[J].Cell,2017,168(1-2):37-57.
[5]Israel A. The IKK complex, a central regulator of
NF-κB activation[J].Cold Spring Harbor perspectives in biology,2010,2(3):a000158.

