原油降解菌的筛选及降油率比较
郑建芳 周飞 刘乔
摘 ?????要:经牛肉膏蛋白胨液体培养基驯化、固体培养基分离纯化,从长庆油田措施废液集中处理后残渣中筛选出了5株具有较强降解石油能力的微生物菌株,将其分别编号为D1、D2、D3、D4、D5。通过形态学和生理生化实验对分离得到的纯种菌株进行鉴定,结果表明D1属于芽孢杆菌属(Bacillus sp.) ,D2属于链球菌属(Streptococcus sp.) ,D3属于黄杆菌属(Flavobacterium Bergey sp.) ,D4属于微球菌属(Micrococcus Cohn sp.) ,D5属于产碱菌属(Alcaligenes sp.)。将得到的5株纯菌株在牛肉膏蛋白胨液体培养基中培养3 d,分别按单株菌株5 mL、2种菌株以1:1的比例各5 mL、3种菌株以1:1:1的比例各5 mL的接种量,分别接种到原油液体培养基中培养,7 d后,按照《CJ/T 57-1999》标准测定原油降解率。比较原油降油率,得到2种菌株组合接种的降油率高于3种菌株组合高于单菌菌株。其中D1、D4按照1:1比例,各5 mL的接种量接种到原油液体培养基中得到的降油率最高,为89.39%。
关 ?键 ?词:分离纯化;菌株鉴定;降油率;菌株组合
中图分类号:X53 ????文献标识码: A ??????文章编号: 1671-0460(2019)02-0256-05
Abstract: Through cultivation and acclimation in the beef paste peptone liquid culture medium, separation and purification, 5 strains of microorganisms with strong petroleum degradation capacity were selected from the residue after concentrated treatment of Changqing oilfield wastewater, and they were numbered as D1 , D2, , D3, D4, D5. The isolated strains were identified by morphology and physiological and biochemical tests. The results showed that D1 belonged to Bacillus sp., D2 belonged to Streptococcus sp., and D3 belonged to Flavobacterium sp., D4 belongs to Micrococcus Cohn sp. and D5 belongs to Alcaligenes sp. The obtained 5 strains of pure strain were cultured for 3 days in the beef paste peptone liquid culture medium. 5 mL of each strain, two strains of each strain at 1:1 ratio of 5 mL, and three strains at 1:1:1 ratio of 5 mL were inoculated in crude oil liquid medium. After 7 days, the degradation rate of crude oil was measured according to "CJ/T 57-1999" standard. Comparing the crude oil degrading rate, the oil degradation rate of the 2 strains inoculated was higher than that of the 3 strains, and was also higher than that of the single strain. Among them, the oil degradation rate of D1 and D4 inoculated into crude oil liquid medium in the ratio of 1:1 and the inoculation amount of each 5 mL was the highest, 89.39%.
Key words: Separation and purification; Strain identification; Oil degradation rate; Strain combination
石油原油是成分复杂难于降解的碳氢化合物,包含多种致癌、致畸、致突变的化学物质[1],甚至干扰人体酶系统,导致肾、肝等内脏病变[2] 。近年来,石油泄露、含油废弃物的排放等造成的土壤污染问题日益严重[3]。因此,治理石油污染势在必行。
目前,含油污泥处理主要有化学处理法、物理处理法和生物处理法。化学处理法可分为溶液淋洗萃取法[4]、电化学法和化学氧化法等[5,6],整体来讲化学处理法虽然处理效率高,但成本高且产生二次污染。物理处理法仅降低含油污泥浓度,无法彻底去除污染物[7,8]。对比化学法与物理法,微生物法修复石油污染土壤具有成本低、效果好以及二次污染小等优点[1]。因此,人们将注意力转向生物法治理石油污染土壤,通过改变生物外部生活環境和依照生物自身的遗传变异规律提高石油降解速度和程度[9-11],此种方法具有手段多样化、降解程度高、代谢旺盛且代谢物无毒害[12]的特点,被认为是生态环境保护领域最有价值、最有前途的和对土壤修复较为彻底的污染修复技术[13,14]。目前,在石油降解菌的筛选及降解特性研究方面取得了诸多进展[1],姚瑶、郑青松对2株石油降解菌DH-5 和DH-9 生长的最适培养基成分以及降解石油的最佳环境条件进行了筛选。研究结果表明,DH-9 对高浓度原油的耐受性明显强于DH-5,而DH-5 对低温的适应性优于DH-9,2个菌株对高盐度的适应性均较强[15]。为了获取对环境无毒害作用且能高效降解石油的菌株,最大限度地提高油污土壤的修复程度,现从长庆油田措施废液集中处理后的残渣中筛选出了5株具有较强降解石油原油的微生物菌株,并对其进行了菌株鉴定,菌株生长曲线与生长过程中pH值变化的测定,以及单株菌株、2种菌株组合与3种菌株组合对原油降解效果的比较。
1 ?材料与方法
1.1 ?实验材料
1.1.1 ?试剂及样品
硫酸镁(MgSO4·7H2O,分析纯),磷酸氢二钾(K2HPO4,分析纯),硝酸铵(NH4NO3,分析纯),磷酸二氢钾(KH2PO4,分析纯),氯化钙(CaCl2·7H2O,分析纯);硫酸铁(FeSO4·7H20,分析纯),氯化钠(NaCl,分析纯),乙二胺四乙酸(EDTA,分析纯),琼脂(生化试剂),牛肉膏(生化试剂),蛋白胨(生化试剂),石油醚(N/A,60~90 ℃,分析纯),无水硫酸钠(Na2SO4,分析纯)。
措施废液集中处理后的残渣:(长庆油田污水处理站,样品名称:地244-70);原油(长庆油田措施废液集中处理后残渣无害化处置项目组)。
1.1.2 ?培养基的制备
微量元素培养基[16]:K2HPO4 4.0 g,MgSO4·7H2O 0.2 g,NH4NO3 4.0 g,KH2PO4 6.0 g,微量元素溶液1 mL(CaCl2·7H2O 1.0 g,FeSO4·7H20 1.0 g),EDTA 1.4 g,去离子水1.0 L。
原油液体培养基:在微量元素培养基的基础上加入0.5%原油。
牛肉膏蛋白胨液体培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL。
牛肉膏蛋白胨固体培养基:在牛肉膏蛋白胨液体培养基中加入18 g琼脂即可制得。
1.1.3 ?主要仪器
DGF-1AB型电热干燥箱 天津泰斯特仪器公司,LSHZ-300 数显冷冻水浴振荡器 太仓实验设备厂,DHP-9082型电热恒温培养箱 上海东麓仪器设备有限公司,光学显微镜 上海光学仪器六厂,722可见分光光度计 杭州科晓化工仪器设备有限公司,AG-285型电子分析天平 梅特勒公司。
1.2 ?实验方法
1.2.1 ?石油降解菌株分离纯化
准确称取10 g样品,加至90 mL已灭菌的生理盐水中,放在165 r/min转速、37 ℃的水浴振荡器上培养。12 h后取出,用移液枪吸取1 mL上清液于一支灭过菌装有9 mL去离子水的试管中,给试管标号1。晃动1号试管,使试管中液体混合均匀,用换过枪头的移液枪吸取1 mL液体于另一支灭过菌装有9 mL去离子水的试管中,给试管标号2,如此反复8次。从5号、6号、7号、8号试管中分别吸取100 μL菌悬液于已灭菌的牛肉膏蛋白胨固体培养基上,涂布(各3组,共12组)。将培养基放置在37 ℃恒温培养箱中,观察。待长出菌落后,对菌落标号,并在牛肉膏蛋白胨固体培养基上采用四区划线法反复划线分离,将得到的纯种菌株接种到牛肉膏蛋白胨斜面中保存。
1.2.2 ?菌株鉴定
采用形态学和生理生化实验对分离得到的纯种菌株进行鉴定,对菌株进行葡萄糖发酵、芽孢染色、吲哚实验[17,18]。依据《伯杰氏细菌鉴定手册》进行菌株鉴定,通过观察菌株形态、生理生化实验,初步鉴定到属[16,19]。
1.2.3 ?菌株生长曲线的测定
将各保存好的菌株接种到已灭菌的牛肉膏蛋白胨液体培养基中,在165 r/min转速、37 ℃的水浴振荡器上,振荡培养20 h,活化菌株;在新鲜已灭菌的牛肉膏蛋白胨液体培养基中加入1 mL活化好的菌液,在165 r/min转速、37 ℃的水浴振荡器上培养;以新鲜已灭菌的牛肉膏蛋白胨液体培养基为空白对照,在波长600 nm处用紫外分光光度计测定其吸光值,直到OD值出现下降,停止测定。
1.2.4 ?菌株生长过程中pH值的测定
将活化好的菌株接种在已灭菌的牛肉膏蛋白胨液体培养基中,在165 r/min转速、37 ℃的水浴振荡器上培养7 d,培养过程中定期测定菌液的pH。
1.2.5 ?菌株接种方式及接种量
将得到的纯种菌株分别接种到100 mL的牛肉膏蛋白胨液体培养基中,各3瓶,在165 r/min转速、37 ℃的水浴振荡器上培养,3 d后取出备用。
在无菌操作台对已灭菌的每瓶150 mL的原油液体培养基标号:D1、D2、D3、D4、D5、D1-2、D1-3、D1-4、D1-5、D2-3、D2-4、D2-5、D3-4、D3-5、D4-5、D1-2-3、D1-2-4、D1-2-5、D1-3-4、D1-3-5、D1-4-5、D2-3-4、D2-3-5、D2-4-5、D3-4-5。按照标号向原油液体培养基中各接种5 mL在牛肉膏蛋白胨液体培养基中培养好的菌液(例如标号为D1-2的原油液体培养基,分别接种D1菌液和D2菌液各5 mL),同时设置D0(D0为不接种菌株的空白对照组),置于165 r/min转速、37 ℃的水浴振荡器上培养7 d(各3组)。
1.2.6 ?原油降解率的测定
单株菌株及组合菌株的原油降解率采用《CJ/T 57-1999》中規定方法进行测定:在原油降解培养体系中加入25 mL石油醚,超声萃取其中的石油,共重复3次,合并上层液于分液漏斗,收集上层液,并向其中加入无水硫酸钠脱水,轻轻摇动,至不结块为止,加盖放置1 h,用预先以石油醚洗提过的滤纸过滤,收集滤液于经烘干恒重的蒸发皿中[20]。将蒸发皿置于65 ℃烘箱中烘干,放于干燥器中冷却30 min,称重直至恒重,[21]计算原油降油率,计算公式如下[22]:
2 ?实验结果与分析
2.1 ?石油降解菌株的分离纯化
在牛肉膏蛋白胨固体培养基中长出的菌落,菌落分布较为均匀,见图1,表明措施废液集中处理后的残渣中确实存在微生物。将分离得到的纯种菌株制作微生物装片,在电子显微镜下观察到微生物形如米粒状,大小、长短不一。
2.2 ?菌株的鉴定
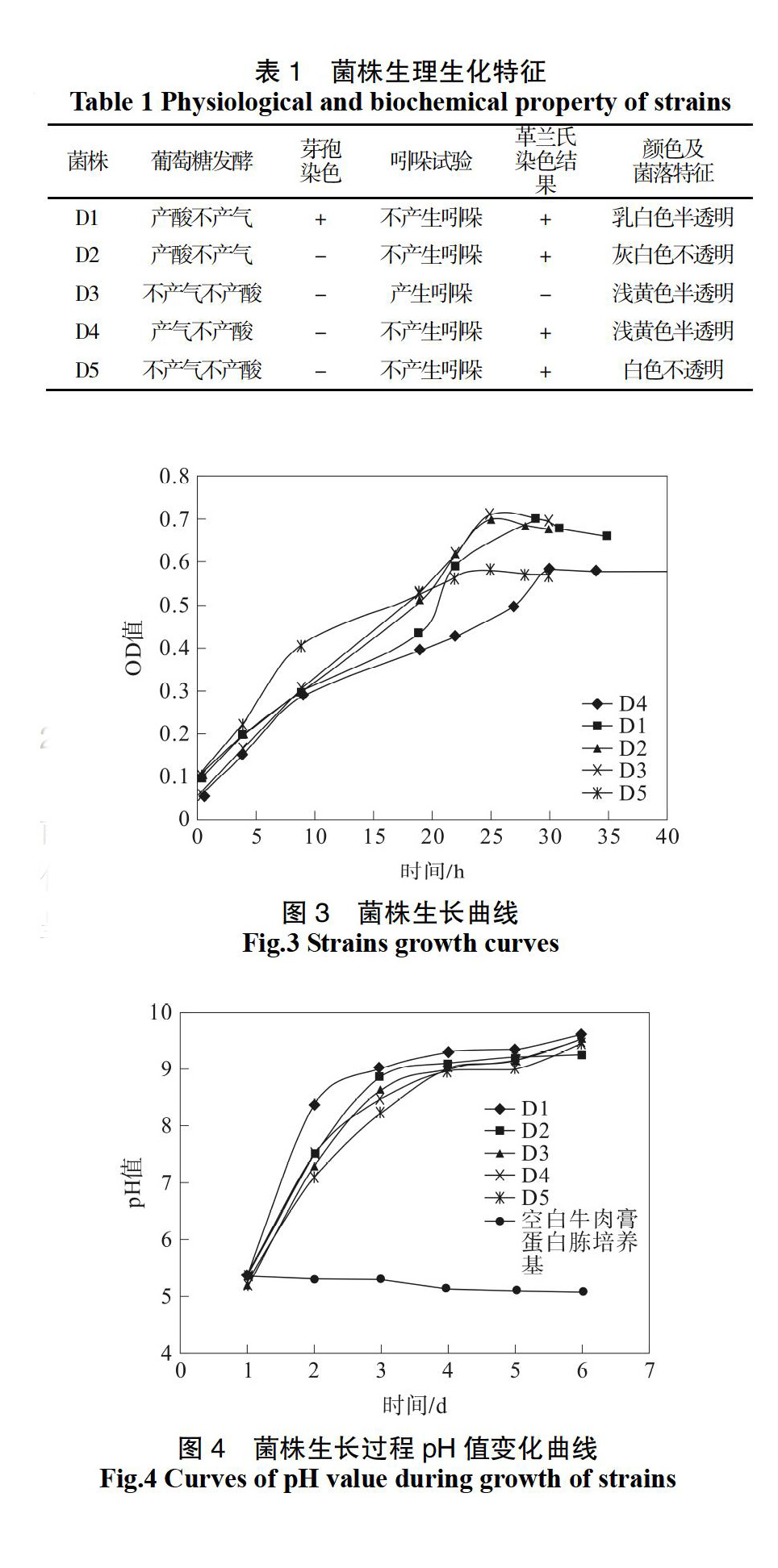
菌株D1产生芽孢、产酸不产气、革兰氏染色结果呈现阳性,表明菌株D1属于芽孢杆菌属(Bacillus sp.)。菌株D2产酸不产气、革兰氏染色
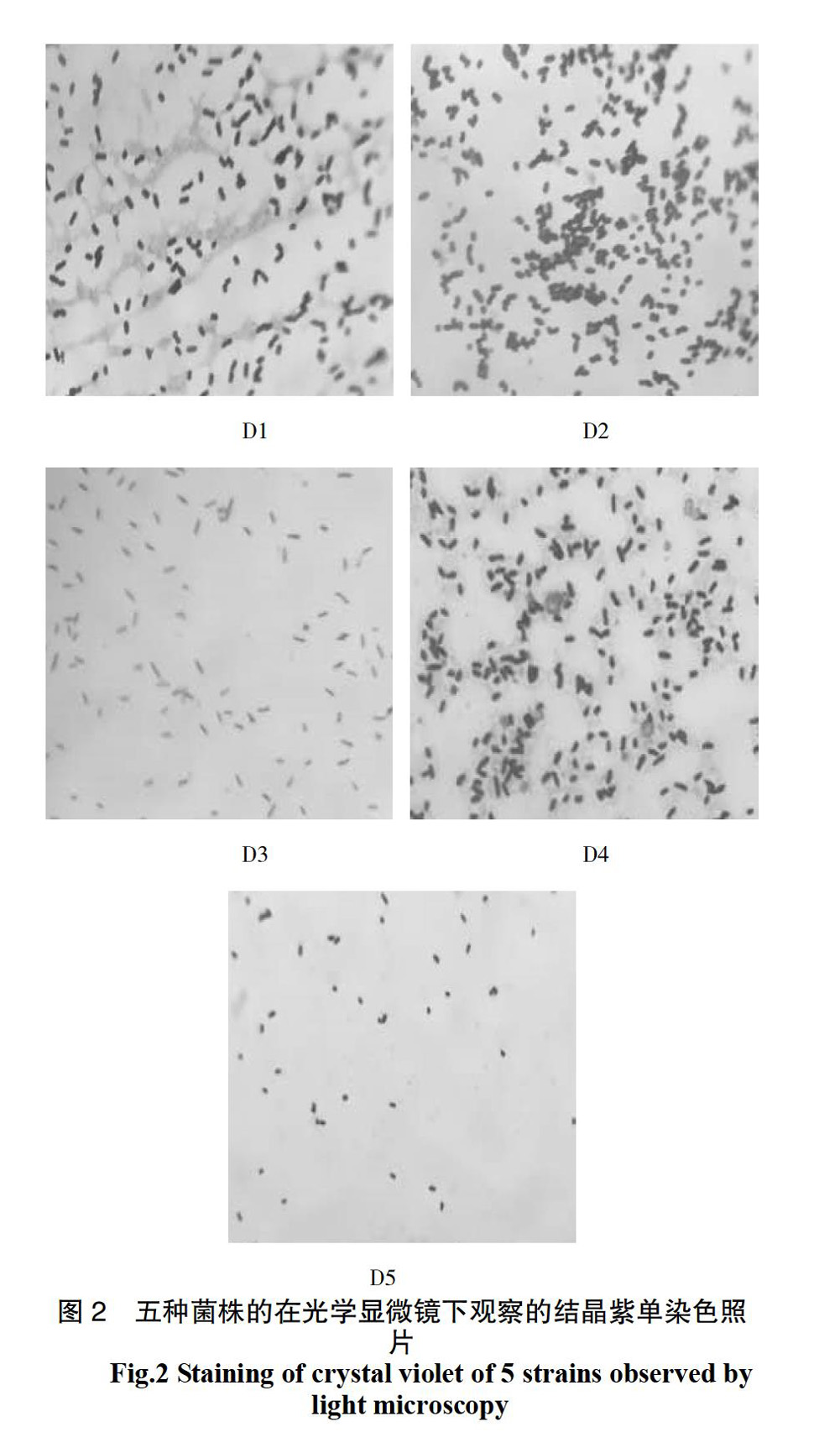
结果呈现阳性、颜色灰白,表明菌株D2属于链球菌属(Streptococcus sp.)。菌株D3产生吲哚、不产气不产酸、革兰氏染色结果呈现阴性,表明菌株D3属于黄杆菌属(Flavobacterium Bergey sp.)。菌株D4不产生芽孢、产气不产酸、革兰氏染色结果呈现阳性,表明菌株D4属于微球菌属(Micrococcus Cohn sp.)。菌株D5不产生吲哚、不产酸不产气、革兰氏染色结果呈现阳性,表明菌株D5属于产碱菌属(Alcaligenes sp.)。5种菌株在光学显微镜下观察的结晶紫单染色照片见图2。
2.3 ?菌株生长曲线
5种菌株各阶段发生时间有所差别,但生长曲线趋势基本相同。菌株D1的对数生长期在接种后18~27 h,30 h时开始进入稳定期,D2的对数生长期在接种后9~25 h,26 h时开始进入稳定期,D3的对数生长期在接种后10~25 h,25 h时开始进入稳定期,D4的对数生长期在接种后8~30 h,30 h时随即开始进入稳定期,D5的对数生长期在接种后10~25 h,30 h时开始进入稳定期,见图3。结果表明,这5种菌株生长迅速,30 h均能达到最大菌数,可以在短时间得到大量的原油降解菌液。
2.4 ?菌株生长过程pH值变化曲线
5株菌株在牛肉膏蛋白胨液体培养基中培养的前4 d,菌液的pH值均成上升趨势,4 d后pH值变化不大。空白的牛肉膏蛋白胨液体培养基的pH值呈现缓慢下降趋势,下降不到1个pH值,见图4。
说明5株菌株在培养过程中会产生使得培养液pH值上升的产物,使得培养液为碱性,有利于微生物对原油的降解。
2.5 ?原油降油率
单菌的降油率D1>D4>D2>D5>D3,降油率最高的菌株是D1,降油率为76.83%,见图5。D1-4组合接种的菌种降油率最高,降油率为89.39%;其次是D1-5组合、D4-5组合,其降油率均大于87%。降油率最低的是D2-3组合,降油率为71.28%,见图6。三菌组合接种的菌种降油率最高的是D1-2-5组合,降油率为86.10%。其次是D1-4-5组合、D2-4-5组合,其降油率均大于84%。降油率最低的是D2-3-5组合,降油率为67.85%,见图7。单就原油降解率而言,两菌组合的降油率优于三菌组合优于单株菌株,菌株组合后接种降油率的高低取决于组合菌株间的不同作用,有的菌株组合接种后起协同作用,有的菌株组合接种后起抑制作用。
3 ?结 论
从长庆油田污水处理站措施废液集中处理后残渣中分离筛选出了5株降解石油能力较强的菌株。降解原油效果最差的是D3,降解率为65.15%;降解原油效果最好的是D1,降解率为76.83%。
2株菌株组合中,降解率最低为71.28%,有6个组合降解率超过83.00%,降解原油效果最好的是D1、D4组合,降解率为89.39%。3株菌株组合中,降解率最低为67.85%,有4个组合降解率超过83.00%,降解原油效果最好的D1、D2、D5组合,降解率为86.10%。某些3株菌株组合的原油降解效果较优于2株菌株组合。5株菌株均能在30 h内达到最大菌数,且菌株会产生碱性产物,为较短时间内去除长庆油田污水处理站措施废液集中处理后残渣中的原油,提供了菌株支持,也为其资源化利用提供了条件。
参考文献:
[1]张斌,朱雷,郭超,等. 土壤石油高效降解菌的筛选、鉴定及其特性研究[J]. 科学技术与工程,2016,16(33):317-322.
[2]张帆,郝春博,王丽华,等. 华北某油田石油降解菌的筛选及降解特性[J]. 环境工程学报,2014,8(10):4533-4539.
[3]刘明,孙鹏,张祥胜. 原油降解菌YSL28的分离鉴定及降解特性研究[J]. 东北农业大学学报,2013,44(05):47-50.
[4]韦朝海,廖建波,刘浔,等. PBDEs来源特征、环境分布及污染控制[J]. 环境科学学报,2015,35(10):3025-3041.
[5]王晓玉,葛树生. 利用电化学技术处理含油污泥[J]. 油气田地面工程,2014,3(6): 62.
[6]Xu J, Pancras T, Grotenhuis T. Chemical oxidation of cable insulating oil contaminatedsoil[J]. Chemosphere, 2011,84 (2): 272-277.
[7]Yang G, Kang D. Enhancing the biodegradation of total petroleum pollutants in oily sludge by a modified bioau-ugmentation strategy[J]. International Biodeterioration & Bio- degradation,2011,65(1):130-134.
[8]刘宇程,王姗镒,马丽丽,等. 石油降解菌筛选鉴定及耐受性分析[J].东北农业大学学报,2017,48(01):49-57.
[9]祝威. 石油污染土壤和油泥生物处理技术[M]. 北京:中国石化出版社,2010,33-34.
[10]孙先锋,杨波波,朱欣洁. 不同生物修复技术处理油污土壤的效果研究[J]. 生物技术通报,2016,32(03):68-72.
[11]杨波波,孙先锋,朱欣洁,等. 堆置法处理油污土壤参数的优化[J].环境工程学报,2016,10(08):4523-4528.
[12]张闻,陈贯虹,高永超,等. 石油和重金属污染土壤的微生物修复研究进展[J]. 环境科学与技术,2012(12):174-181.
[13]王悦明,王继富,李鑫,等. 石油污染土壤微生物修复技术研究进[J].环境工程, 2014,32(08):157-161+130.
[14]王悦明,王继富,李鑫,等.石油污染土壤微生物修复技术研究进展[J]. 环境工程,2014,32(08):157-161+130.
[15]姚 瑶,郑青松,刘兆普,等. 2株石油降解菌生长和降解石油条件的优化[J]. 生态与农村环境学报,2011,27(5):48-53.
[16]金芬. 电场强化复合微生物菌种修复油污土壤的研究[D]. 西安工程大学,2015.
[17]刘舒.陕北地区石油污染土壤微生物修复菌种选育研究[D]. 西安:西安工程大学,2013.
[18]刘宇程,王姗镒,马丽丽,等. 石油降解菌筛选鉴定及耐受性分析[J].东北农业大学学报,2017,48(01):49-57.
[19]朱妍,赵敏,杨琴,等. 电动力强化对微生物修复石油污染土壤的影响[J]. 油气田环境保护,2016,26(03):21-25+61.
[20]周力超. 应用于油脂废水处理的全细胞脂肪酶的构建及其应用[D]. 湖北大学,2012.
[21]王庆莲. 大庆油田典型含油固废热解处理及资源化探讨[D]. 大庆石油学院,2009.
[22]李乐,周飞,孙先锋. 石油降解菌的筛选及复合菌群的构建[J]. 当代化工,2018,47(04):672-676.

