铜与浓硫酸反应实验分析及创新改进
程志平
摘要:本文通过分析苏教版和人教版中铜与浓硫酸反应实验装置的优缺点及实际操作过程中存在的问题,并在借鉴他人改进的基础上,提出创新的设计,简化了装置和操作,提高了实验的绿色性和成功率,同时丰富了该实验的功能,使其更有利于激发学生的学习兴趣,培养学生探究精神和创新意识。
关键词:铜与浓硫酸反应;装置改进;绿色化 探究性
中图分类号: G633.8 文献标识码:A 文章编号:1006-3315(2015)07-046-002
1. 研究背景
铜与浓硫酸反应是高中化学教学中的一个经典演示实验,该反应对学生理解浓硫酸的强氧化性,巩固SO2气体的检验方法,养成绿色环保意识具有重要的意义。人教版(图1)[1]和苏教版(图2)[2]均给出了相应的反应装置: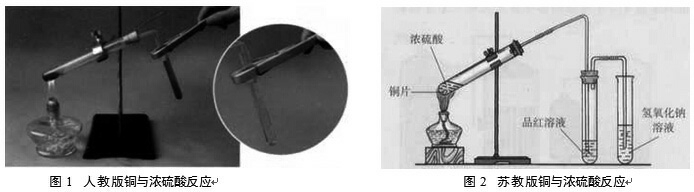
人教版的装置采用抽拉铜丝的方法可以控制反应的进行,用试管夹夹住盛有品红的试管,便于褪色后加热复色,以进一步验证SO2,但是该装置无尾气吸收装置,反应结束后无法处理SO2,且实际操作中抽拉铜丝比较困难,需要一手握住试管,一手抽拉铜丝,不知如何腾出手来夹持试管?若先移开试管,再抽铜丝,则会造成大量SO2逸出,污染环境。
苏教版的装置考虑了尾气处理,但是使用铜片不利于控制反应。由于SO2溶解度较大,容易发生倒吸,笔者按照苏教版的装置进行实验,反应结束后竟然不知道如何操作?如果先撤酒精灯,则很快倒吸,导致试管爆裂,浓硫酸洒出,非常危险;如果后撤酒精灯,则需要将两支试管中的导管都拔出来,也会导致大量SO2逸出。且图2中两支试管都要固定,装置较复杂。
两种方案都使用品红溶液检验SO2气体,实际操作过程中发现褪色较慢,反应时间过长。
在此基础上,许多老师进行了改进,较为典型的如《化学教学》2012年第9期魏崇启老师发表的《浓硫酸与铜反应实验的创新改进》一文给出了三种改进装置[3],如下图3、4、5所示: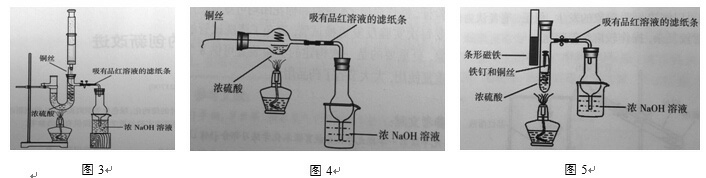
采用吸有品红的滤纸条检验SO2缩短了反应时间;用不同的方式控制铜丝与浓硫酸接触与分离,达到控制反应的目的;用球型干燥管防倒吸。
但是同样存在着一些问题,比如装置都较复杂,要用到2个铁架台固定;图3所需浓硫酸用量明显偏多;图4其实转动铜丝不是很方便;图5根据笔者实际操作,磁铁根本无法吸取铁钉拉动铜丝。
此外这个实验有许多异常现象,比如试管底部有灰黑色固体,铜丝表面变黑,学生对此非常感兴趣,如果能抓住这“愤”的时机,适时进行“启”,让学生充分猜想,并设计实验验证自己的猜想,就能很好地培养学生的创新精神 ,而要进行这方面的探究,均要打开塞子,残留在装置中的SO2会逸出污染环境,教材装置和上述改进装置均缺乏进行进一步探究的功能。
2. 设计思想
简化装置和操作,节约药品,绿色环保,便于课堂内实现多功能的探究。
3. 方案设计
3.1实验仪器及试剂
铁架台(带铁夹)、酒精灯、“Y”型管、医用塑料滴管、直铜丝、绕成螺旋状的铜丝、气球、棉花、镊子、导管a(90度弯管,孔径较小)、导管b(孔径较大,能将导管a套入)、棉线、双孔橡胶塞、98%浓硫酸、品红试纸、浓NaOH溶液、碳酸钠固体、蒸馏水
3.2实验装置
实验装置见图6
3.3实验步骤、现象及结论
(1)按图6搭好装置,检验装置气密性,放好药品。
(2)用镊子夹住铜丝伸入至与浓硫酸接触,无明显现象,说明常温下铜与浓硫酸不反应。拉出铜丝,与浓硫酸脱离接触。
(3)加热浓硫酸至沸腾,用镊子夹住铜丝迅速伸入与浓硫酸接触,立即产生大量气体,气球先变大,再慢慢变小;约10秒左右品红试纸褪色,说明有SO2气体产生;溶液略微变蓝,说明有Cu2+产生;管底出现大量灰白色固体,铜丝表面变黑。将铜丝抽出与浓硫酸脱离接触,反应立刻停止。
(4)加热b导管,品红试纸重新变回红色,进一步证明有SO2气体生成。
(5)探究灰白色固体的成分(学生推测可能是无水CuSO4):将“Y”型管向右倾斜,将剩余的浓硫酸倒入右管与碳酸钠固体反应,产生的CO2气体将管内SO2气体排入气球内吸收。挤压医用塑料滴管,让蒸馏水滴入左管,发现灰白色固体溶解,溶液变为蓝色,但是仍有少量黑色的固体,证明此灰白色固体主要成分是无水硫酸铜。进一步分析原因时可巩固学生对浓硫酸吸水性的理解。
(6)探究铜丝表面变黑的原因(学生推测可能是CuO):由于上步操作已经将装置中残留SO2排尽,此时可以直接打开塞子,用镊子取下下端的螺旋状铜丝,置于一支盛有稀硫酸的试管中,稍加热发现溶液变成浅蓝色,铜丝表面重新变成光亮的紫红色,溶液中仍有少量黑色固体,说明铜丝表面主要成分是CuO,但是仍旧有不与稀硫酸反应的黑色物质,可让学生根据元素组成猜测可能的成分,并课外查资料自学求证。
4. 实验创新之处及优点
(1)装置简单,操作方便。除加热浓硫酸的操作需要将“Y”型管固定在铁架台上外,其余所有操作均可拿在手上操作,甚至可以走到学生中间操作,增强了课堂演示效果。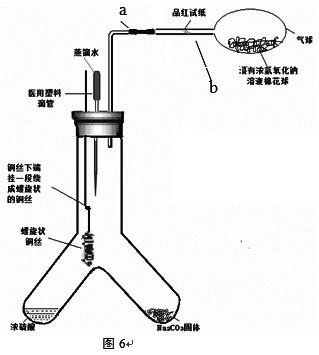
(2)实验内容丰富,将课堂演示和实验探究巧妙地结合起来。既探究了铜与浓硫酸反应的原理,又巩固了产物的检验(CuSO4和SO2)方法,同时针对出现实验异常现象,及时让学生猜测可能的原因、设计实验方案、实施实验,能较好的培养学生创新精神和实验能力。
(3)右管中的碳酸钠固体与硫酸反应产生的CO2气体将装置中残留的SO2气体排出,便于打开塞子取出铜丝,对黑色固体进行进一步探究,同时也处理了余酸。
(4)铜丝下端卷成螺旋状,可增大接触面积,加快反应的进行。采用挂在直铜丝上的目的是方便伸入左管,同时可以及时取下更换,便于换班操作。
(6)利用品红试纸检验SO2气体,可以减少SO2的量,缩短反应所需时间,故可以减少浓硫酸和铜的使用量。按照教材中实验,浓硫酸需要2mL,品红需要2mL,所需时间大约1分钟,改进后的方案浓硫酸只需1mL,品红试纸一小张,整个实验总花费时间只需30秒左右。
(7)利用装有氢氧化钠的气球吸收SO2气体,避免了溶液倒吸。
(8)导管a套入导管b内,用乳胶管相连,再系上棉绳,这样的设计增加了装置稳定性,不容易出现由于重心不稳导致装置倾斜。
(9)导管a较长,起到冷凝作用,有利于缩短品红褪色的时间。
(10)实验结束后只要打开乳胶管,用玻璃棒将导管b内的品红试纸捅到气球里,再更换一张品红试纸,重新挂一段铜丝,换一支“Y”型管即可,换班上课有充分的时间准备,非常方便。
(11)b导管内还可以放pH试纸、吸有酸性高锰酸钾的滤纸等,可以综合探究SO2气体的还原性、漂白性、酸性等性质。
参考文献:
[1]宋心琦主编.化学1(普通高中课程标准实验教科书)[M]北京:人民教育出版社,2004:85
[2]王祖浩主编.化学1(普通高中课程标准实验教科书)[M]南京:江苏教育出版社,2010:92
[3]魏崇启.铜与浓硫酸反应实验的创新改进[J]化学教学,2012,(9):47-48

