解析质量守恒定律在初中化学中的应用
张华山
摘要:质量守恒定律是初中化学最基本的定律,可以直接反映化学反应内容,尤其从宏观角度可以得知,其质量在发生化学反应前后不会有变化,从微观角度分析,化学物质原子数量在发生化学反应前后不会发生改变,更不会改变原子质量,因而称为质量守恒定律.该定律可以将复杂烦琐的化学问题简单化,改变传统学生因复杂问题而丧失学习兴趣现状,极大提高了化学教学效率.对此,本文则从应用质量守恒定律解决宏观问题、探究实验现象,以及培养学生缜密思维等分析其具体应用策略,望能够为化学教师提供教学参考.
关键词:初中化学 质量守恒定律 应用
质量守恒定律是初中化学教学重要组成部分,很多化学问题都需要借助质量守恒定律进行分析和解答,因而需要初中化学教师在教学中帮助学生掌握质量守恒定律并加以科学合理地应用.学生在理解质量守恒定律时可从化学反应实质着手,原子重新组合全新的分子或分子破裂成原子后得出质量守恒微观原因,即化学反应前后原子数目、种类、质量均不变,最终得出化学反应前后各个物质质量总和不变,由此对质量守恒定律加深印象,进一步提高化学学习效率.
一、应用质量守恒定律解决宏观问题
在解答化学问题时应用质量守恒定律可以解决宏观问题.例如,在测定水的组成时可以借助氢气还原氧化铜实验,在實验过程中先对测量反应前先测量玻璃管和氧化铜总质量,结果数据为62.5 g,U型管和氯化钙总质量为90.8 g.经化学反应后,玻璃管及其中物质总质量则为56.2 g,U型管和氯化钙总质量为98 g.根据上述实验数据可以计算水的质量即n2-n1=98 g -90.8 g =7.2 g.之后再借助质量守恒定律得知,化学反应后生成物水中的氧元素来自氧化铜,质量m2-m1=62.5 g -56.2 g =6.4 g,再根据水由氧和氢两种元素组成,计算出生产物水中氢元素质量为7.2 g -6.4 g =0.8 g,最后得出水中氧元素和氢元素质量.
二、应用质量守恒定律探究实验现象
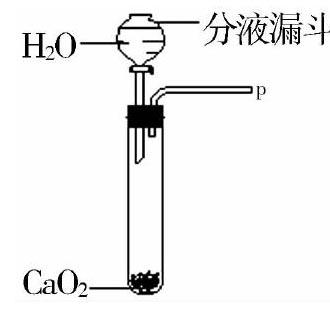
在初中化学实验中也可应用质量守恒定律探究现象,例如,以下问题:在长途运输鱼苗时人们会选择在水中添加少量过氧化钙固体,小王发现往水中投入过氧化钙后会产生气泡.为了进一步研究反应后会生成哪种气体则运用图1装置开展实验.装置中分液漏斗的活塞主要用于控制滴水速度并观察试管内是否出现气泡,运用带火星的木条慢慢靠近P区,木条燃烧,说明生成气体为________________________________________?由此可知在运输鱼苗时添加过氧化钙的目的为了________________________________________.小王根据质量守恒定律认为过氧化钙与过量水反应还会产生某种含有钙元素产物,小王假设CaO为该产物,然而通过详细思考后立即否认这个猜想,并重新假设生成的含钙产物为Ca(OH)2.解释小王对原先假设的理由:________________________________________.解答:首先氧气能促使带火星的木条复燃并能提供呼吸,因此生成的气体为氧气,目的在于为鱼苗提供氧气.因为氧化钙和水反应可以生成氢氧化钙,则填CaO遇水变成Ca(OH)2.
三、应用质量守恒定律培养缜密思维
相关调查研究结果显示,无论教师在课堂上采取哪种教学方式提问,回答的学生寥寥无几.可以说一个会学习的人会不断发现问题并在分析问题和解决问题中得到成长,这种获得知识途径往往比被动式接受教师传授的知识更有意义.知识有着广泛的内涵且相互之间有着紧密联系,当前教学的重点和难点就在于如何在准确把握知识内涵的基础上促使学生不断发现问题并学会解决问题,由此才能真正提高教学效果.以“碱的性质”一课为例,教材中提出“如何保存NaOH”,此时化学教师应循序渐进继续提出问题:NaOH为何会变质?如何证明NaOH变质?变质后有哪些成分?甚至还可引导学生思考在空气中Ca(OH)2如何变化的?为何运用Ca(OH)2改良土壤?通过循序渐进的问题让学生体会思考对于科学研究的重要性.虽然酸碱盐有较多的知识内容,然而酸碱的化学性质具有一定的规律,因为酸溶液中都含有H+,碱中含有OH-,然而盐没有共同的结构成分.对此可以让学生思考不同物质之间的关系,从而会得知非金属氧化物能与碱产生反应,活泼金属和金属氧化物能与酸发生反应,经过不断地交流、探究及归纳总结就可深入分析酸碱盐之间的关系.
总之,在初中化学中应用质量守恒定律效果显著,该定律在初中化学知识中占据十分重要的地位,学生只有充分掌握这一定律才能熟练地运用所学知识分析和解决化学问题,达到提高化学水平目的.最重要该定律能将复杂烦琐的化学题目简化,调动学生参与化学学习积极性,丰富学生学习体系,进一步提高化学教学效率和教学质量.

摘要:质量守恒定律是初中化学最基本的定律,可以直接反映化学反应内容,尤其从宏观角度可以得知,其质量在发生化学反应前后不会有变化,从微观角度分析,化学物质原子数量在发生化学反应前后不会发生改变,更不会改变原子质量,因而称为质量守恒定律.该定律可以将复杂烦琐的化学问题简单化,改变传统学生因复杂问题而丧失学习兴趣现状,极大提高了化学教学效率.对此,本文则从应用质量守恒定律解决宏观问题、探究实验现象,以及培养学生缜密思维等分析其具体应用策略,望能够为化学教师提供教学参考.
关键词:初中化学 质量守恒定律 应用
质量守恒定律是初中化学教学重要组成部分,很多化学问题都需要借助质量守恒定律进行分析和解答,因而需要初中化学教师在教学中帮助学生掌握质量守恒定律并加以科学合理地应用.学生在理解质量守恒定律时可从化学反应实质着手,原子重新组合全新的分子或分子破裂成原子后得出质量守恒微观原因,即化学反应前后原子数目、种类、质量均不变,最终得出化学反应前后各个物质质量总和不变,由此对质量守恒定律加深印象,进一步提高化学学习效率.
一、应用质量守恒定律解决宏观问题
在解答化学问题时应用质量守恒定律可以解决宏观问题.例如,在测定水的组成时可以借助氢气还原氧化铜实验,在實验过程中先对测量反应前先测量玻璃管和氧化铜总质量,结果数据为62.5 g,U型管和氯化钙总质量为90.8 g.经化学反应后,玻璃管及其中物质总质量则为56.2 g,U型管和氯化钙总质量为98 g.根据上述实验数据可以计算水的质量即n2-n1=98 g -90.8 g =7.2 g.之后再借助质量守恒定律得知,化学反应后生成物水中的氧元素来自氧化铜,质量m2-m1=62.5 g -56.2 g =6.4 g,再根据水由氧和氢两种元素组成,计算出生产物水中氢元素质量为7.2 g -6.4 g =0.8 g,最后得出水中氧元素和氢元素质量.
二、应用质量守恒定律探究实验现象
在初中化学实验中也可应用质量守恒定律探究现象,例如,以下问题:在长途运输鱼苗时人们会选择在水中添加少量过氧化钙固体,小王发现往水中投入过氧化钙后会产生气泡.为了进一步研究反应后会生成哪种气体则运用图1装置开展实验.装置中分液漏斗的活塞主要用于控制滴水速度并观察试管内是否出现气泡,运用带火星的木条慢慢靠近P区,木条燃烧,说明生成气体为________________________________________?由此可知在运输鱼苗时添加过氧化钙的目的为了________________________________________.小王根据质量守恒定律认为过氧化钙与过量水反应还会产生某种含有钙元素产物,小王假设CaO为该产物,然而通过详细思考后立即否认这个猜想,并重新假设生成的含钙产物为Ca(OH)2.解释小王对原先假设的理由:________________________________________.解答:首先氧气能促使带火星的木条复燃并能提供呼吸,因此生成的气体为氧气,目的在于为鱼苗提供氧气.因为氧化钙和水反应可以生成氢氧化钙,则填CaO遇水变成Ca(OH)2.
三、应用质量守恒定律培养缜密思维
相关调查研究结果显示,无论教师在课堂上采取哪种教学方式提问,回答的学生寥寥无几.可以说一个会学习的人会不断发现问题并在分析问题和解决问题中得到成长,这种获得知识途径往往比被动式接受教师传授的知识更有意义.知识有着广泛的内涵且相互之间有着紧密联系,当前教学的重点和难点就在于如何在准确把握知识内涵的基础上促使学生不断发现问题并学会解决问题,由此才能真正提高教学效果.以“碱的性质”一课为例,教材中提出“如何保存NaOH”,此时化学教师应循序渐进继续提出问题:NaOH为何会变质?如何证明NaOH变质?变质后有哪些成分?甚至还可引导学生思考在空气中Ca(OH)2如何变化的?为何运用Ca(OH)2改良土壤?通过循序渐进的问题让学生体会思考对于科学研究的重要性.虽然酸碱盐有较多的知识内容,然而酸碱的化学性质具有一定的规律,因为酸溶液中都含有H+,碱中含有OH-,然而盐没有共同的结构成分.对此可以让学生思考不同物质之间的关系,从而会得知非金属氧化物能与碱产生反应,活泼金属和金属氧化物能与酸发生反应,经过不断地交流、探究及归纳总结就可深入分析酸碱盐之间的关系.
总之,在初中化学中应用质量守恒定律效果显著,该定律在初中化学知识中占据十分重要的地位,学生只有充分掌握这一定律才能熟练地运用所学知识分析和解决化学问题,达到提高化学水平目的.最重要该定律能将复杂烦琐的化学题目简化,调动学生参与化学学习积极性,丰富学生学习体系,进一步提高化学教学效率和教学质量.

